Cetilpiridinium-klorid és benzidamin-hidroklorid fix dózisú kombinációját tartalmazó szopogató tabletta influenza A vírus elleni virucid hatása
23. 8. 2022
ABSZTART
KULCSSZAVAK: cetilpiridinium-klorid, benzidamin-hidroklorid, H3N2 altípusú influenza A vírus, légúti fertőzés
HÁTTÉR. A vírusok a pharyngitis leggyakoribb okai. Bár a legtöbb légúti fertőzés spontán gyógyul, a betegek nagyon gyakran alkalmaznak maguktól különböző kezeléseket. A benzidamin-hidroklorid (BH) és cetilpiridinium-klorid (CPC) fix dózisú kombinációját tartalmazó szopogató tabletták hatásosnak bizonyultak a panaszokat okozó torokfájás enyhítésében. Az antiszeptikus hatású CPC ismert hatékony baktericid szer, és egyes kutatások megerősítik bizonyos burkos vírusokkal szembeni hatékonyságát is. MÓDSZEREK. A vizsgálat célja a szabad hatóanyagok, illetve szopogató tabletta formájában alkalmazott CPC, illetve BH/CPC fix dózisú kombináció az influenza A vírussal szembeni in vitro virucid hatásosságának értékelése volt. A vírust és a tesztanyagok különböző koncentrációjú szuszpenzióit 1 percig, 5 percig és 15 percig inkubáltuk, majd meghatároztuk a fertőző vírusok mennyiségét. EREDMÉNYEK. A BH/CPC fix dózisú kombinációt tartalmazó szopogató tabletta nagy koncentrációjú szuszpenzióban már egy perc után 4 log10(c) értékkel csökkenti a vírustitereket, míg a szabad hatóanyagként alkalmazott CPC, illetve BH/CPC esetében hasonló csökkenés csak 5 perc után érhető el. A BH/CPC szopogató tabletták közepes koncentrációjú szuszpenzióban is elérik a vírustiter 4 log10(c) értékkel való csökkenését, 5–15 perc közötti időtartam alatt. MEGBESZÉLÉS. Az in vitro vizsgálatok eredményei a BH/CPC tartalmú szopogató tabletták az influenza A vírus elleni hatékony, erős virucid hatását bizonyítják.
HÁTTÉR
Az új koronavírus, a SARS-CoV-2 (súlyos akut légzőszervi szindróma koronavírus 2) járvány kitörése kiterjedt kutatásokhoz vezetett a vírusfertőzés kezelésének és megelőzésének módját illetően. Az orális fertőtlenítőszerek meglehetősen nagy figyelmet kaptak, mivel feltételezhetően képesek csökkenteni a szájüreg vírusterhelését és ezáltal a fertőzés kockázatát. A tudományos adatok alapján az egyik legígéretesebb szer a cetilpiridinium-klorid (CPC), mivel széles körű antibakteriális és vírusellenes hatása van.1 Bizonyos klinikai vizsgálatok kimutatták, hogy a CPC-t tartalmazó szájöblítő képes csökkenteni az új koronavírus általi vírusterhelést, és így potenciálisan szerepet játszik a Covid-19 hatásának mérséklésében.2,3
Önálló anyagként vagy más hatóanyagokkal kombinálva a CPC-t általában szájöblítő folyadékot tartalmazó, szájüregi használatra szánt termékekben, illetve szopogató tabletták és spray-k formájában alkalmazzák. A légúti vírusfertőzés az egyik leggyakoribb betegségtípus a világon, amely általában torokfájással, köhögéssel, lázzal és nyálkahártya-gyulladással jár. Bár a legtöbb vírusfertőzés magától megszűnik, és nem igényel speciális kezelést, a betegek gyakran használnak saját maguktól olyan készítményeket, amelyek enyhítik a tüneteket vagy semlegesítik a fertőzés okát.4 A benzidamin-hidroklorid (BH) és CPC fix dózisú kombinációját tartalmazó szopogató tabletták klinikailag hatékonyak a torokfájás tüneteinek enyhítésében.5 A SARS-CoV-2-re gyakorolt virucid hatásukat nemrégiben in vitro vizsgálatokban igazolták.6 A CPC az influenzavírus különböző törzseivel szembeni virucid hatásosságát is kimutatták. Egyes in vitro tesztek a vírusburkolat lebomlását mutatták ki a hatóanyaggal való érintkezés hatására.7
Az Általános Orvosi Kar Mikrobiológiai és Immunológiai Intézetében végzett vizsgálat célja a BH és CPC fix dózisú kombinációját tartalmazó szopogató tabletták influenza A vírusra gyakorolt in vitro virucid hatásának igazolása volt, ezzel egyidejűleg összehasonlítva azt a szabad hatóanyagok formájában alkalmazott CPC, illetve BH és CPC kombináció virucid hatásával. Így szerettük volna felmérni az egyéb hatóanyagok (BH) és a szopogató tabletták segédanyagainak a virucid hatásosságra kifejtett lehetséges hatását.
MÓDSZEREK
A vizsgálatokat a Szlovén Szabványügyi Intézet által a humán gyógyászatban alkalmazott virucid hatás értékelésére meghatározott módszerekkel és követelményekkel összhangban végezték el.8 A tesztelési körülményeket és az érintkezési időket az emberi szájüreg fizikai-kémiai tulajdonságainak megfelelően választottuk ki és igazítottuk hozzá, figyelembe véve olyan tényezőket, mint a hőmérséklet, az összetétel (biológiai terhelés) és a nyál mennyisége, amely a szopogató tabletták feloldódása során képződik, valamint a szopogató tabletták feloldódásának dinamikája (különböző érintkezési idők).
A vírus izolációja és kvantifikációja
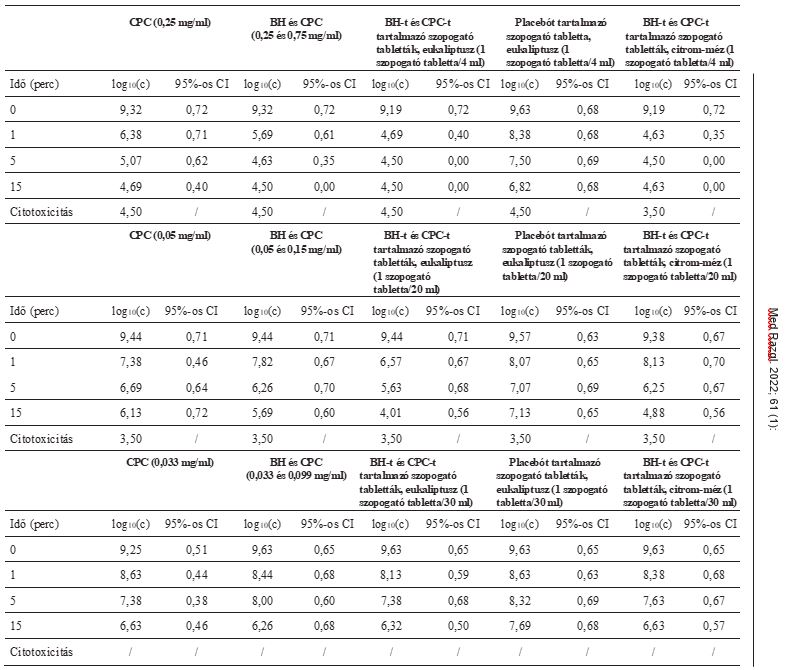
A vizsgált ortomyxovírust, azaz az influenza A vírus, A/Victoria/3/75, hemagglutinin 3 neuraminidáz 2 (H3N2) törzsét az ATCC (American Type Culture Collection) törzsgyűjteményéből szereztük be. Előzetesen sejtkultúrában szaporították, és meghatározták a vírus mennyiségét. Madin–Darby kutyavese (MDCK) sejteket és a legkisebb bázikus táptalajt használtuk 10% magzati szarvasmarha szérum (FGS) és TPCK szarvasmarha hasnyálmirigyből származó tripszin hozzáadásával, 2 µg/m végső tripszin koncentrációban. A vírusizolátum koncentrációját Spearman–Kärber-módszerrel határoztuk meg.9 A vírustörzshöz egy olyan vírushígítást rendeltünk (milliliterenkénti vírusegységben kifejezve), amelynél a vírus a sejttenyészetben lévő sejtek 50%-át fertőzi meg – ez a medián szövettenyésztési fertőző dózis, TCID50/ml. A szaporított vírus kilépési koncentrációja 109,41 TCID50/ml volt (1. táblázat).
A virucid hatás vizsgálata és az ellenőrzési eljárások
A vizsgált anyagokat kemény vízben oldottuk egy zavaró anyag hozzáadásával (a továbbiakban szuszpenzió), hogy biológiai szempontból „stresszes” körülményeket teremtsünk, és szimuláljuk a nyál összetételét. A szuszpenzió szarvasmarha-szérumalbumin (BSA) (3,0 g/l víz) és vörösvérsejtek 3,0 ml/l koncentrációjú oldata volt. A víruskultúrákat 1 perces, 5 perces, illetve 15 perces expozíciós idővel inkubáltuk 37 °C-on a vizsgált anyagokkal, ami megfelel az átlagos elszopogatási időnek (5–10 perc). A vizsgált anyagok háromféle koncentrációját használtuk, amelyeket a vizsgált anyag 4 ml (magas koncentráció), 20 ml (közepes koncentráció) és 30 ml (alacsony koncentráció) szuszpenzióban való feloldásával állítottunk elő. A vizsgált anyagokat a 2. táblázat tartalmazza.
A virucid hatás tesztelésével egyidejűleg elvégeztük a releváns sejt- és vírusellenőrzést, a vírusellenőrzést a vizsgálat teljes inkubációs ideje alatt, továbbá értékeltük a vizsgált anyag gátló hatását jéghideg sejttáptalajban, a vizsgált anyag hatását a sejtek vírus iránti fogékonyságára, valamint a sejtekre gyakorolt citotoxikus hatását.
1. táblázat: A tesztelés során használt kilépési víruskoncentrációk. CI – konfidenciaintervallum; H3N2

2. táblázat: Tesztelt vizsgálati anyagok. BH – benzidamin-hidroklorid; CPC – cetilpiridinium-klorid; E – Európa; FCF – élelmiszer-színezék

EREDMÉNYEK
Ellenőrző vizsgálati eredmények
A tesztelési körülmények között a vírus végig stabil volt a vizsgálat során, és a fertőző vírusok koncentrációja nem csökkent jelentősen. Kimutatták a hideg sejttáptalaj gátló hatását a nagy koncentrációban alkalmazott vizsgált anyag (vizsgált anyag 4 ml táptalajban oldva) által kifejtett hatásra. A vírustiter az expozíció előtt és után nem különbözött jelentősen, és nem haladta meg a szabvány által határértékként meghatározott koncentrációérték 1 mínusz log10 (c) értékét.
A legnagyobb nem citotoxikus koncentrációban egyik vizsgált anyag sem befolyásolta a sejtek vírus iránti fogékonyságát. Csak nagyon kicsi, de még elfogadható eltéréseket figyeltünk meg.
A vizsgált anyagok citotoxicitását nagy koncentrációban 10-1 és 10-11 közötti hígításokon vizsgáltuk. A sejtréteg deformációjával vagy pusztulásával járó citotoxicitást mutattak ki a CPC, a szabad hatóanyagként alkalmazott BH és CPC kombináció, a BH-t és CPC-t tartalmazó, eukaliptusz ízű szopogató tabletta, valamint a placebót tartalmazó eukaliptusz ízű szopogató tabletta esetében, 10-1 és 10-2 hígításban. A citrommal és mézzel ízesített, BH-t és CPC-t tartalmazó szopogató tabletta, valamint a placebót tartalmazó, citrommal és mézzel ízesített szopogató tabletta esetében azonban csak 10-1 hígításban mutattak ki citotoxicitást. Ez határozta meg azt a határértéket, amelynél érdemes megállapítani a vírus citopátiás hatását. A citotoxicitás szintjét a vizsgált szuszpenzió vírus hígításának függvényében a 4. táblázat mutatja.
A vizsgált anyagok vírusinaktiválásra gyakorolt hatásának eredményei
Minden tesztelt koncentrációt kétszer, különböző napokon vizsgáltunk. A végeredményt a két vizsgálat átlagaként adjuk meg. Az eredmények numerikus formában a 3. és 4. táblázatban, grafikusan pedig az 1., 2. és 3. ábrán láthatók.
A virucid hatás a legmagasabb koncentrációnál (egy szopogató tabletta 4 ml szuszpenzióban feloldva) kifejezetten erős volt. Közepes koncentrációnál (egy szopogató tabletta 20 ml szuszpenzióban feloldva) a virucid hatás még mindig jelen volt, de megváltozott dinamikával, mivel hasonló hatás csak 15 perc elteltével volt megfigyelhető.
Az eredmények számottevő különbséget mutatnak a hatóanyagot tartalmazó és a placebo szopogató tabletták virucid hatása között. Ez leginkább magas és közepes koncentrációknál észlelhető, de alacsony koncentrációknál is megfigyelhető.
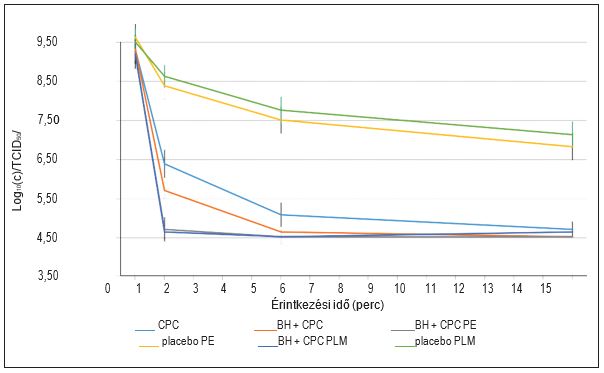
1. ábra: Az influenza A vírus expozíciója a vizsgált anyag legmagasabb koncentrációjával (egy szopogató tabletta 4 ml szuszpenzióban feloldva) három különböző érintkezési időben. TCID50/ml – 50%-os medián szövettenyésztési fertőző dózis), CPC – cetilpiridinium-klorid; BH – benzidamin-klorid; PE – szopogató tabletta, eukaliptusz; PLM – szopogató tabletta, citrom-méz.
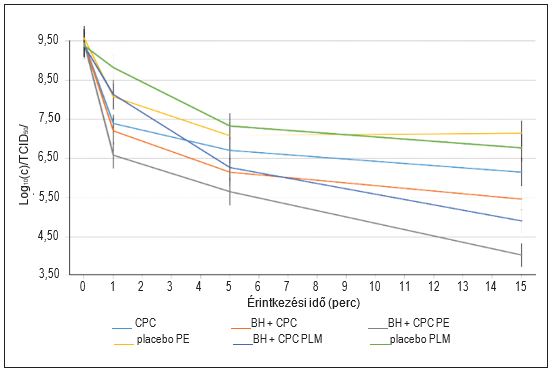
2. ábra: Az influenza A vírus expozíciója a vizsgált anyag közepes koncentrációjával (egy szopogató tabletta 20 ml szuszpenzióban feloldva) három különböző érintkezési időben. TCID50/ml – 50%-os medián szövettenyésztési fertőző dózis), CPC – cetilpiridinium-klorid; BH – benzidamin-klorid; PE – szopogató tabletta, eukaliptusz; PLM – szopogató tabletta, citrom-méz.
3. táblázat: Tesztelt anyagok pH-értékkel és az influenza A vírus fertőző részecskéi koncentrációjának csökkentése a koncentráció és az érintkezési idő alapján. CPC – cetilpiridinium-klorid, BH – benzidamin-klorid, CI – konfidenciaintervallum
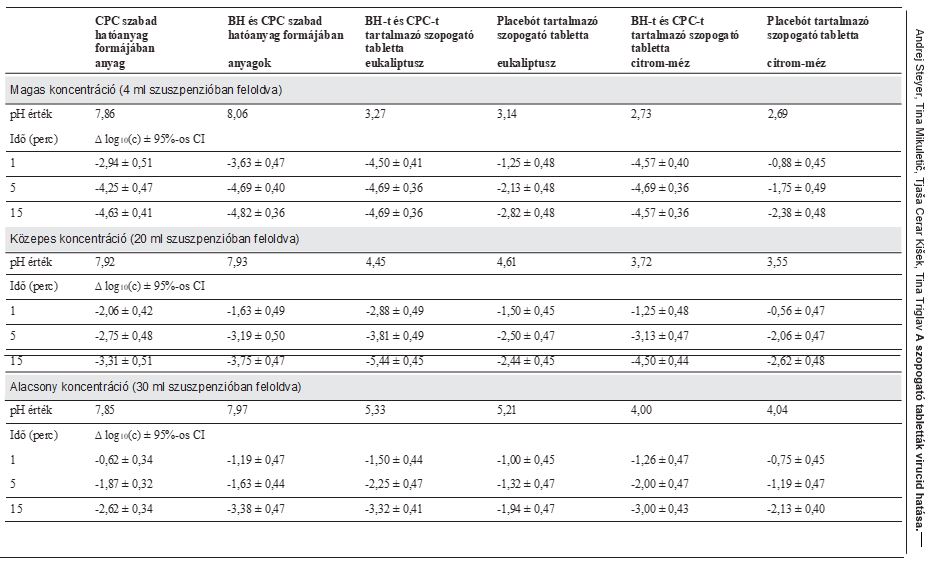
4. táblázat: Az influenza A vírusra gyakorolt virucid hatás vizsgálatának eredményei. CPC – cetilpiridinium-klorid, BH – benzidamin-klorid, CI – konfidenciaintervallum
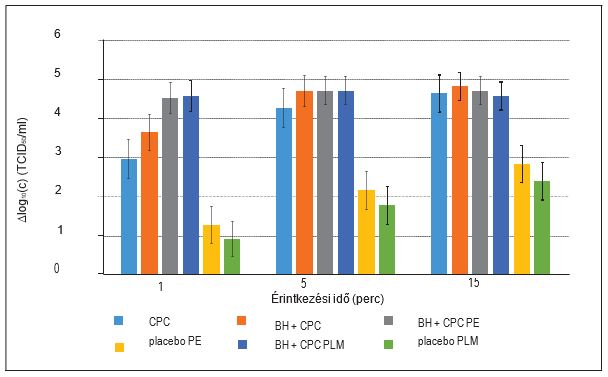
3. ábra: A fertőző vírusmennyiség csökkenésének összehasonlítása a legmagasabb koncentráció (egy szopogató tabletta 4 ml szuszpenzióban feloldva) mellett három különböző érintkezési időben. TCID50/ml – 50%-os medián szövettenyésztési fertőző dózis), CPC – cetilpiridinium-klorid; BH – benzidamin-klorid; PE – szopogató tabletta, eukaliptusz; PLM – szopogató tabletta, citrom-méz..
MEGBESZÉLÉS
Egyes korábbi vizsgálatok kimutatták a CPC virucid hatását az influenzavírus ellen.7 Egy nemrégiben végzett in vitro vizsgálatban kimutatták a BH és CPC kombinációját tartalmazó szopogató tabletták SARS-CoV-2 vírus elleni hatásosságát. A legmagasabb koncentrációjú vizsgált anyagot tartalmazó szuszpenzióban a víruskoncentráció már egy perc elteltével 4 log10(c) értékkel csökkent.6
Ez a vizsgálat a várakozásoknak megfelelően hasonló tendenciákat mutatott a BH és CPC kombinációját tartalmazó szopogató tabletták influenza A vírus elleni virucid hatása tekintetében. Mindkét esetben olyan burkos vírusokat használtak in vitro, amelyekre a CPC vélhetően közvetlenül hat.6,7 A vizsgálatokat ugyanazon protokoll és ugyanolyan feltételek mellett végezték, mint a SARS-CoV-2 vírussal végzett vizsgálatokat.
A fontos különbség csak a fenntartó táptalajban lévő tripszin volt, amelyet az influenzavírusok fertőzőképességének biztosítása végett kellett hozzáadni. A tripszin rendkívül alacsony koncentrációja miatt a táptalajban nem tudtuk tesztelni a vizsgált anyagra gyakorolt hatását, mivel a vírus kezdeti inkubálása az anyaggal tripszin hozzáadása nélkül történt. Csak ahhoz a táptalajhoz adtuk hozzá, amelyben a vírus és a vizsgált anyag hígításait a sejttenyészetekbe való bevitel előtt készítettük.
A legnagyobb virucid hatást az összes vizsgált anyag a várakozásoknak megfelelően a magas koncentrációjú szuszpenziókban mutatta, ahol kimutattuk, hogy a fertőző vírusok koncentrációja már öt perc elteltével több mint 4 log10 (c) értékkel (10 000-szeres értékkel vagy 99,99%-kal) csökken. A BH és CPC kombinációját tartalmazó (eukaliptusz ízesítésű, valamint citrom- és mézízesítésű) szopogató tabletták hatására a koncentráció már egy perc után 4 log10 (c) értékkel csökkent (1. és 3. ábra). Az összes ellenőrzési eljárást figyelembe véve az eredmények a vizsgált anyagok magas virucid hatásosságát jelzik. A placebót tartalmazó szopogató tabletták (eukaliptusz-, citrom- és mézízesítésű szopogató tabletták) virucid hatása jelentősen különbözik a BH és CPC kombinációját tartalmazó szopogató tabletták hatásától, amint az az 1. ábrán, a 3. ábrán és a 4. táblázatban látható. A BH és CPC kombinációját tartalmazó szopogató tabletták a fertőző vírusok koncentrációjának 4 log10 (c) értékkel történő releváns csökkentését érték el a közepes koncentrációjú szuszpenziókban is, ami a szopogató tabletta feloldódásának dinamikájára és a nyálelválasztásra (kb. 4,0–5,0 ml/perc stimuláló tevékenységek, pl. a szopogató tabletta szopogatása során) vonatkozó összes paramétert figyelembe véve a legközelebb állt a szopogató tabletta tényleges használatakor feltételezett koncentrációhoz, feltéve, hogy a szopogató tabletta feloldódása 5–10 percet vesz igénybe.10 A szabad anyag formájában alkalmazott CPC, illetve a BH és CPC kombináció szintén megközelítette a 4 log10 (c) redukciós határértéket.
A SARS-CoV-2-vel végzett korábbi in vitro vizsgálatokhoz hasonlóan az influenzavírussal végzett vizsgálatokban a vizsgált anyagok alacsony koncentrációját tartalmazó szuszpenziók még 15 perc elteltével sem érték el a 4 log10 (c) értékkel való csökkenést.6
A víruskoncentráció egyértelműen csökkenő tendenciája volt megfigyelhető a 15 perces érintkezési idő alatt a vizsgálat anyagot tartalmazó szuszpenziókban minden koncentráció esetében (kivéve a placebót tartalmazó szopogató tablettákat).
Mind a BH és CPC kombinációját tartalmazó szopogató tabletták, mind a szabad hatóanyagként alkalmazott BH és CPC egyértelmű virucid hatást mutattak: a leggyorsabb hatás a legmagasabb koncentrációnál jelentkezett, és a hatás mértéke csökkent a koncentráció csökkenésével. A víruskoncentráció csökkenését ábrázoló görbe közepes koncentráció mellett idővel laposabb lett, és ez még inkább nyilvánvaló volt a legalacsonyabb koncentráció mellett (1. ábra és 2. ábra). Ez a dinamika nem volt megfigyelhető a placebót tartalmazó szopogató tablettáknál (egyik ízesítés esetében sem), amelyeknél 15 perc után állandó hatás mutatkozott: a fertőző vírusok koncentrációjának csökkenése 1,94 és 2,82 log10 (c) közötti volt. Amint azt a SARS-CoV-2 vírussal végzett in vitro vizsgálatokban már megállapították, az inaktiváló tényező valószínűleg szintén az alacsony pH-érték, amely a BH és CPC kombinációját tartalmazó szopogató tablettákéhoz hasonló.6
Az egyik legfontosabb tulajdonság, amellyel egy orális antiszeptikus készítménynek rendelkeznie kell, az a szubsztantivitás. Tudjuk, hogy a CPC szubsztantivitása magas (3-5 óra), ami nagyobb mértékű és hosszabb ideig tartó vírus elleni hatásosságot eredményezhet.1 Ezenkívül a gyógyszerforma is hozzájárulhat a hatásossághoz. A pharyngitis helyi tüneteinek enyhítésére szolgáló gyógyszerformák közé tartoznak a szájvizek, a spray-k és a szopogató tabletták. Kimutatták, hogy a szopogató tabletták esetében a hatóanyag kezdetben nagyobb mértékben rakódik le a szájüregben és a torokban, és lassabban mosódik ki a szájüregből, mint a spray-k és a szájvizek (gargalizálás) esetében. Ez arra utal, hogy a szopogató tabletták hatása hosszabb ideig tarthat.11
A vizsgálati eredmények ellenőrzött laboratóriumi körülményeken alapulnak, amelyekkel megpróbáltuk szimulálni a szájüreg élettani viszonyait.
Számos tényező miatt az in vitro vizsgálatok eredményeit nem lehet átültetni in vivo körülményekre, még akkor sem, ha figyelembe vesszük azokat a fizikai-kémiai körülményeket, amelyeket megpróbáltunk utánozni. A vizsgálat csupán azt mutatta ki, hogy a CPC, a szabad hatóanyagokként alkalmazott BH és CPC kombinációja, valamint a szopogató tabletta formájában alkalmazott BH és CPC kombinációja virucid hatású, és valószínűleg a szájüreg és a garat nyálkahártyáján is hasonló hatást fejtenek ki. A virucid hatás mindenesetre a nyálkahártyán vagy nyálban lévő szabad fertőző vírusokra korlátozódna, amelyek közvetlenül érintkeznének a hatóanyaggal. A szakirodalmi adatok szerint a vírusrészecskék koncentrációja a nyálban a 4–6 log10 (c) vírusgenom-kópia per milliliter tartományba esik.12 A vizsgálatok során lényegesen magasabb víruskoncentrációkat (8–10 log10 (c) fertőző vírusrészecske per milliliter) használtunk. Célszerű további kutatásokat végezni klinikai vizsgálatok formájában. Ha az eredmények hasonló hatásosságot mutatnának, akkor a BH és CPC kombinációját tartalmazó szopogató tabletták alkalmazása jelentősen csökkenthetné a cseppfertőzés valószínűségét.
Az in vitro vizsgálat kimutatta a CPC, valamint a szabad hatóanyag, illetve szopogató tabletták formájában alkalmazott BH és CPC kombinációjának az influenza A vírus elleni virucid hatását.
A legnagyobb mértékű hatásosságot, amely jelentősen különbözött a placebót tartalmazó szopogató tabletták hatásosságától, a BH és CPC kombinációját tartalmazó szopogató tabletták esetében mutatták ki. Ez a hatásosság hasonló volt az eukaliptusz ízesítésű, valamint a citrom- és mézízesítésű szopogató tabletták esetében.
Szerzők:
- Andrej Steyer, Közegészségügyi Mikrobiológiai Osztály, Nemzeti Egészségügyi, Környezetvédelmi és Élelmiszeripari Laboratórium, Prvomajska ulica 1, 2000 Maribor
- Dr. Tina Mikuletič, Mikrobiológiai és Immunológiai Intézet, Ljubljanai Egyetem, Orvosi Kar, Zaloška cesta 4, 1000 Ljubljana
- Dr. Tjaša Cerar Kišek, Mikrobiológiai és Immunológiai Intézet, Ljubljanai Egyetem, Orvosi Kar, Zaloška cesta 4, 1000 Ljubljana
- Dr. Tina Triglav, Mikrobiológiai és Immunológiai Intézet, Ljubljanai Egyetem, Orvosi Kar, Zaloška cesta 4, 1000 Ljubljan
Irodalom:
- Mateos-Moreno MV, Mira A, Ausina-Márquez V, Ferrer MD. Oral antiseptics against coronavirus: In-vitro and clinical evidence. J Hosp Infect. 2021; 113: 30–43.
- Ming-Hsu C, Po-Chun C. The effectiveness of mouthwash against SARS-CoV-2 infection: A review of scientific and clinical evidence. J Formos Med Assoc. 2021; S0929-6646(21)00469–1.
- Seneviratne CJ, Balan P, Ko KKK, et al. Efficacy of commercial mouth-rinses on SARS-CoV-2 viral load in saliva: Randomized control trial in Singapore. Infection. 2021; 49: 305–11.
- Morokutti-Kurz M, Graf C, Prieschl-Grassauer E. Amylmetacresol/2,4-dichlorobenzyl alcohol, hexylresorcinol, or carrageenan lozenges as active treatments for sore throat. Int J Gen Med. 2017; 10: 53–60.
- Košir P. Primerjalna raziskava terapevtske enakovrednosti med testnim in referenčnim zdravilom fiksne kom- binacije 3 miligramov benzidaminijevega klorida in 1 miligrama cetilpiridinijevega klorida pri preiskovancih z vnetim žrelom, povezanim z okužbami zgornjih dihal. Med Razgl. 2015; 54 (3): 433–42.
- Steyer A, Marušić M, Kolenc M, et al. A throat lozenge with fixed combination of cetylpyridinium chloride and benzydamine hydrochloride has direct virucidal effect on SARS-CoV-2. COVID. 2021; 1 (2): 435–46.
- Popkin DL., Zilka S, Dimaano M, et al. Cetylpyridinium chloride (CPC) exhibits potent, rapid activity against influenza viruses in vitro and in vivo. Pathog Immun. 2017; 2 (2): 252–69.
- SIST EN 14476:2013+A2:2019 [internet]. Ljubljana: Slovenski inštitut za standardizacijo; c2009 [citirano 2021 Dec 10]. Dosegljivo na: http://ecommerce.sist.si/catalog/project.aspx
- Kärber G. Beitrag zur kollektiven Behandlung pharmakologischer Reihenversuche. Arch. Exp. Path. Pharm. 1931; 162: 480–7.
- Iorgulescu G. Saliva between normal and pathological. Important factors in determining systemic and oral health. J Med. Life. 2009; 2 (3): 303–7.
- Farrer F. Sprays and lozenges for sore throats. S Afr Pharm J. 2011; 78 (4): 26–31.
- Kw To K, Lu L, Cy Yip C, et al. Additional molecular testing of saliva specimens improves the detection of res- piratory viruses. Emerg Microbes Infect. 2017; 6 (6): e49.