A borostyánlevél-kivonatot tartalmazó 35 mg-os szopogató tabletták hatásossága és biztonságossága akut bronchitisben szenvedő köhögő betegeknél: Összehasonlítás a referenciakészítménnyel
23. 8. 2020
ABSZTRAKT
KULCSSZAVAK: akut bronchitis, borostyánkivonat, szopogató tabletta, Hedera helix, produktív köhögés
HÁTTÉR. Az akut bronchitis olyan klinikai diagnózis, amelyet akut köhögés jellemez, ami leggyakrabban köpettermeléssel jár (azaz produktív köhögés), és az alsó légúti fertőzés jeleivel, és amelyet gyakran vírusok okoznak. A borostyánlevél-kivonatok (Hedera helix) klinikailag bizonyítottan hatásos gyógyszerek az akut bronchitis kezelésében. A klinikai vizsgálat célja az volt, hogy bizonyítsa a Krka borostyánlevél kivonatot tartalmazó 35 mg-os szopogató tablettáinak (tesztelt vizsgálati készítmény, TIMP) non-inferioritását egy referenciakészítménnyel, nevezetesen a belsőleges oldathoz való, borostyánlevél-kivonat 35 mg granulátum belsőleges oldathoz készítménnyel (referencia vizsgálati készítmény, RIMP) összehasonlítva akut bronchitises köhögésben szenvedő betegeknél, valamint hogy bizonyítsa a két kezelési lehetőség biztonságossági profiljának hasonlóságát. MÓDSZEREK. A nyílt elrendezésű, összehasonlító, randomizált, multicentrikus, non-inferioritási vizsgálatba 115 felnőtt, 18 és 63 év közötti, akut bronchitishez társuló köhögésben szenvedő beteget vontak be. A betegek mindkét csoportban 7 napig szájon át szedték az előírt gyógyszereket az előírt adagolási rend szerint. Minden betegnek két személyes viziten kellett megjelennie a vizsgálóorvosnál (a 0. vagy az 1. napon és a 8. napon), továbbá két telefonhívást kellett tennie (a 4. napon és a 14. napon, legfeljebb két nap késéssel) a hatásossági és/vagy biztonságossági végpontok értékelése céljából. EREDMÉNYEK. A Bronchitis Severity Score (Bronchitis súlyossági pontszám) értékének átlagos változása a kiindulási értéktől a kezelés végéig –6,15 volt a TIMP csoportban és –6,25 a RIMP csoportban. A bronchitis súlyosságának a kiindulási érték és a korrigált átlagos változása közötti, az előre meghatározott határértéknél alacsonyabb különbség (p = 0,6441) igazolta a vizsgált készítmény non-inferioritását. A másodlagos hatásossági végpontok a vizsgált és a referenciakészítményekkel kezelt csoportokban statisztikailag nem különböztek szignifikánsan. A köhögés súlyosságának javulása –59,8 volt a TIMP-, illetve –58,7 a RIMP-csoportban (p = 0,5270). A köhögés gyakorisága a TIMP csoportban –4,83 ponttal, míg a RIMP csoportban –4,75 ponttal csökkent (p = 0,6808). A köhögés, a beteg életének különböző aspektusaira gyakorolt hatásának korrigált átlagos változása 6,94 volt a TIMP csoportban és 7,09 a RIMP csoportban (p = 0,6441). A nemkívánatos események előfordulása és gyakorisága mindkét kezelési csoportban alacsony volt. A vizsgálók egyik nemkívánatos eseményt sem hozták összefüggésbe a vizsgálati készítményekkel. KÖVETKEZTETÉSEK. A Krka borostyánlevél-kivonatot tartalmazó 35 mg-os szopogató tablettájának hatásossága nem bizonyult rosszabbnak, mint a referenciakészítmény (borostyánlevél-kivonat 35 mg granulátum belsőleges oldathoz). Mindkét kezelés statisztikailag szignifikáns javulást eredményezett valamennyi vizsgált paraméter tekintetében. A biztonságossági elemzés biztonságosságot és jó tolerálhatóságot igazolt az akut bronchitisben jelentkező köhögésben szenvedő betegeknél.
BEVEZETÉS
A köhögés az egyik leggyakoribb ok, amiért a betegek háziorvoshoz fordulnak, és az akut bronchitis domináns és meghatározó tünete. Az akut bronchitis olyan klinikai diagnózis, amelyet akut köhögés jellemez, ami leggyakrabban köpettermeléssel jár (azaz produktív köhögés), és az alsó légúti fertőzés jeleivel, és amelyet gyakran vírusok okoznak (1).
A produktív köhögés kezelésére olyan gyógyszerek javasoltak, amelyek segítik a nyálka kiürülését a légutakból. Az ilyen hatóanyagok a köptetőszerek csoportjába tartoznak, és nyákoldó (a váladék viszkozitását csökkentő), mukokinetikus (a ciliáris transzport hatásosságát növelő) és/vagy szekretolitikus tulajdonságokkal rendelkeznek, ez utóbbi a borostyánból (Hedera helix) származó növényi szerekre is vonatkozik. (2). A Hedera helix kb. 2–6% triterpén-szaponinokat tartalmaz, mint pl. az α-hederin és hederakozid C, valamint B, D, E, F, G, H és I hederaszaponinokat. A gyógyszer ezenkívül flavonoidokat és illóolaj-összetevőket is tartalmaz. A borostyánlevél kivonatának jól ismert gyógyászati felhasználása bizonyos lágy, folyékony és száraz kivonatokra vonatkozik. Ezek közül a vizsgálatban a borostyánlevél száraz kivonatát (DER 5–7,5:1) használtuk, amelyhez extrakciós oldószerként 30% (m/m) etanolt adtunk hozzá (3). A borostyánlevél-kivonat hörgőgörcsoldó, nyákoldó és szekretolitikus tulajdonságokat mutatott, továbbá a gyulladáscsökkentő hatást is vizsgálták (4; 5; 6; 7). A közzétett Európai Fitoterápiás Tudományos Szövetkezet (ESCOP, European Scientific Cooperative on Phytotherapy) monográfia szerint a borostyánlevelet tartalmazó gyógynövénykészítmények javallottak köhögés esetén, különösen a viszkózus nyák túlzott mértékű szekréciója esetén, valamint gyulladásos hörgőbetegségek kiegészítő kezelésére (8).
Számos klinikai és nem intervenciós vizsgálatot végeztek borostyánlevél-kivonatokkal, amelyek a készítmények hatásosságát és jó tolerálhatóságát igazolták felnőttek és gyermekek akut légzőszervi megbetegedéseinek kezelésében. Schonknecht és munkatársai a borostyánlevél szirup formájában alkalmazott száraz kivonatának hatásosságát és biztonságosságát mutatták ki egy multicentrikus, nyílt elrendezésű, engedélyezés utáni, hatásossági vizsgálatban. A vizsgálati csoport 480, 2 és 12 év közötti, akut produktív köhögésben szenvedő betegből állt. A 8 napos kezelés után a felső légutak vírusfertőzésében szenvedő betegek 90,1%-ánál, a bakteriális fertőzésben szenvedő betegek 96,8%-ánál és az akut bronchitisben szenvedő betegek 99,1%-ánál jelentették a köhögés enyhülését vagy megszűnését (2). A hosszú távú klinikai alkalmazásból származó és a szakirodalmi adatok mellett, a körülbelül 7000 gyermekkel végzett prospektív klinikai vizsgálatokban, valamint egy, körülbelül 52 000 gyermekkel végzett retrospektív vizsgálatban is kimutatták a borostyánkészítmények jó tolerálhatóságát (3).
A klinikai vizsgálat elsődleges célja az volt, hogy igazolja a Krka, borostyánlevél-kivonatot tartalmazó 35 mg-os szopogató tablettájának non-inferioritását a referenciakészítménnyel (borostyánlevél-kivonat 35 mg granulátum belsőleges oldathoz) összehasonlítva akut bronchitis okozta köhögésben szenvedő betegeknél.
A másodlagos cél a TIMP biztonságosságának és tolerálhatóságának értékelése volt a RIMP-hez képest akut bronchitis okozta köhögésben szenvedő betegeknél.
MÓDSZEREK
A két párhuzamos csoportban végzett nyílt elrendezésű, összehasonlító, randomizált, multicentrikus, non-inferioritási vizsgálatot 2019 februárjától 2019 áprilisáig (a klinikai rész) végezték az Orosz Föderációban. A vizsgálatot az Eurázsiai Gazdasági Bizottság által jóváhagyott helyes klinikai gyakorlatnak megfelelően végezték. A vizsgálatba 18 és 63 év közötti felnőtt betegeket vontak be, akiknél a tüdőgyógyász által igazolt akut bronchitishez köhögés és köpetürítési nehézség társult, és akiknél a bronchitis súlyossági pontszáma (BSS) legalább 7 pontos volt a 20-ból, a köhögés intenzitása/súlyossága ≥ 50 mm volt a 100 mm-es vizuális analóg skálán (VAS) és a köhögési pontozási rendszer (CSS, Cough Scoring System) szerinti pontszám ≥ 6 pontos volt a 10-ből. A vizsgálatba nem választottak be olyan betegeket, akiknek a legutóbbi dohányzási epizódja kevesebb mint 6 hónappal a vizsgálat megkezdése előtt zajlott, akiknek testhőmérséklete 38,5°С-nál magasabb volt, akiknek a С-reaktív protein szintje magasabb volt 100 mg/l-nél, vagy akik túlérzékenyek voltak a borostyánlevél száraz kivonatára vagy a vizsgálatban alkalmazott készítmények bármely más összetevőjére. A klinikai vizsgálatba nem vonták be azokat a betegeket sem, akiket egyidejűleg nem szteroid gyulladáscsökkentőkkel, β2-szimpatomimetikumokkal, ACE-gátlókkal, β-adrenerg blokkolókkal, nitrofuránokkal, aranykészítményekkel, szulfaszalazinnal, penicillaminnal, metotrexáttal kezeltek és/vagy akiket szisztémás antibakteriális szerekkel, vírusellenes szerekkel kezeltek, immunszuppresszánsokkal, szisztémás vagy inhalációs glükokortikoidokkal, teofillinnel kezeltek kevesebb mint négy héttel a vizsgálati készítmény (IMP) első beadását megelőzően, illetve nyákoldókkal, szekretolitikumokkal, köptetőkkel és köhögéscsillapítókkal kezeltek kevesebb mint 7 nappal a vizsgálati készítmény első beadását megelőzően vagy paracetamollal 6 órával a beválasztás előtt. Ugyanez vonatkozik azokra a betegekre, akiknél a beválasztás előtt 48 óránál hosszabb ideig tartó köhögés, thrombophlebitis, trombózisra való hajlam, diabetes mellitus, hyperoxaluria, hemokromatózis, hematológiai betegségek, gastrooesophagealis reflux, postnasalis (váladékcsorgás miatt köhögés okozta) ájulás szindróma, szarkoidózis, kötőszöveti betegségekkel összefüggő köhögés, asbestosis, szilikózis, farmer tüdő, akut vagy krónikus sinusitis, vagy rendellenes köpetürítés áll fenn. A kizárási kritériumok közé tartozott a túlzott alkoholfogyasztás, a kábítószerrel való visszaélés, a kábítószer-függőség, a terhesség és a szoptatás is.
A betegeket a következő két kezelési csoport egyikébe randomizálták: Krka borostyánlevél-kivonatot tartalmazó 35 mg-os szopogató tabletta (a tesztelt vizsgálati készítmény, TIMP) vagy borostyánlevél-kivonat 35 mg granulátum belsőleges oldathoz (a referencia vizsgálati készítmény, RIMP). A kezelési időszak 7 napig tartott. Minden betegnek két személyes viziten kellett megjelennie a vizsgálóorvosnál (1. vizit és 2. vizit), valamint két telefonhívást (1a. vizit és 2a. vizit) kellett tennie. Az 1. vizit alkalmával elvégezték a szűrést és a randomizálást, valamint meghatározták az elsődleges és másodlagos végpontok meghatározásához szükséges kiindulási értékeket. A 2. viziten (a kezelés megkezdését követő 8. napon) értékelték az elsődleges és másodlagos hatásossági végpontokat. Az 1a., a 2. és 2a. vizit alkalmával biztonságossági monitorozást végeztek (1. ábra).
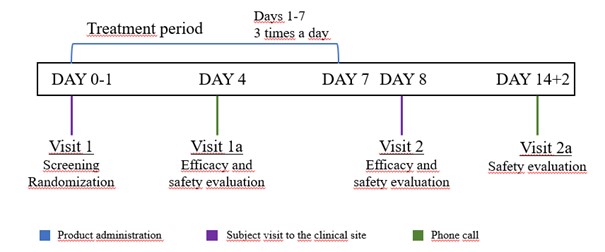
1. ábra. A vizsgálat elrendezése: +2 – legfeljebb két napos késlekedés; 1. vizit – első személyes vizit a vizsgálóorvosnál; 2. vizit – második személyes vizit a vizsgálóorvosnál; 1a. vizit – első telefonbeszélgetés a vizsgálóorvossal; 2a. vizit – második telefonbeszélgetés a vizsgálóorvossal.
Azokat a betegeket, akik aláírták a klinikai vizsgálatban való részvételre vonatkozó beleegyező nyilatkozatot, és megfeleltek a bevonási kritériumoknak, 7 napig kezelték 35 mg borostyánlevél száraz kivonattal (DER 5–7,5 : 1). A TIMP csoportban a betegek a borostyánlevél kivonatot tartalmazó 35 mg-os szopogató tablettát (egy tablettát szopogatva a teljes feloldódásig) szedték naponta háromszor 7 napig. A RIMP csoportban a betegek a referenciaként szolgáló, borostyánlevél-kivonatot tartalmazó 35 mg granulátumból készült belsőleges oldatot (egy tasak tartalmát feloldva per os naponta háromszor 7 napon keresztül) szedtek. A vizsgálati készítmény első adagját az 1. vizit alkalmával adták be. A vizsgálati készítmény mellett mindkét vizsgálati csoportnak aszkorbinsav szedését (napi négyszer 100 mg szájon át), 38,0 °C-nál magasabb testhőmérséklet esetén paracetamol szedését (500 mg szájon át naponta legfeljebb négyszer, legalább négy óra különbséggel), meleg italok fogyasztását (legalább napi két liter) és háttérterápiaként ágynyugalmat javasoltak a vizsgálat 7 napja alatt.
Az 1. vizit alkalmával az orvosok az általános kórtörténet felvételével, antero-posterior és oldalirányú mellkasröntgen-felvétel és a légzésszám mérése révén ellenőrizték a bevonási és kizárási kritériumoknak való megfelelést. Az akut bronchitis diagnózisát pulmonológus erősítette meg.
Az elsődleges és másodlagos hatásossági végpontok és a biztonságossági profil értékelésére általánosan elfogadott skálákat és kérdőíveket használtak: Bronchitis súlyossági skála (BSS) 5 pontos verbális leíró pontszámmal a bronchitises tünetek súlyosságának értékelésére (0 – nincs, 4 – nagyon súlyos) (9), VAS a köhögés értékelésére (2. ábra), Köhögés pontozási rendszer (CSS, Cough Scoring System) a köhögés gyakoriságának értékelésére és Leicester-féle köhögés kérdőív (Leicester Cough Questionnaire, LCQ) – akut. Az LCQ egy 19 kérdésből álló, köhögésspecifikus egészségi állapotra vonatkozó kérdőív a fizikai, mentális és szociális területek értékelésére. Az értékeléshez 7 pontos Likert-skálát használtak. Az elsődleges és másodlagos hatásossági végpontokat a skálák és a kérdőív értékének a 2. és az 1. vizit közötti különbségei alapján értékelték.

2. ábra. Vizuális analóg skála (VAS) a köhögés súlyosságának értékelésére
A CSS esetében a köhögés, mind a napközbeni, mind az éjszakai tevékenységekre kifejtett hatását értékelték (1. táblázat).
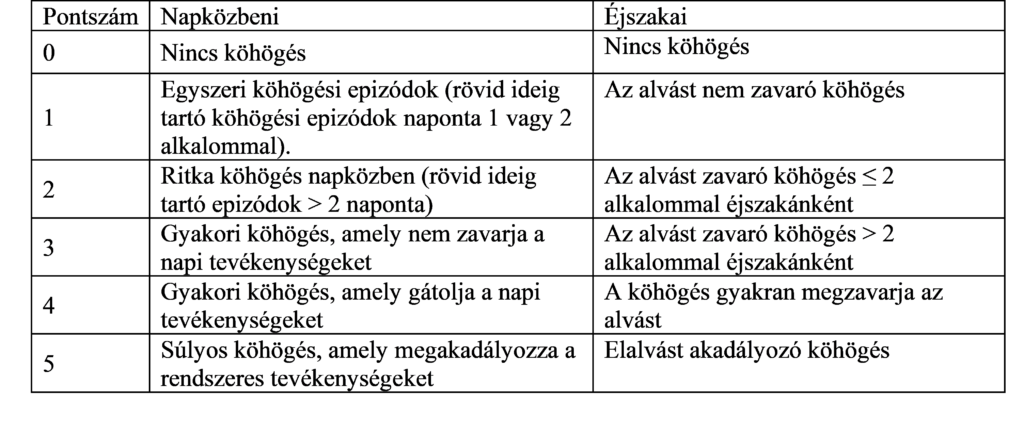
1. táblázat: Köhögés tünetpontszáma (CSS)
A telefonos viziten (1a. vizit) a vizsgálók értékelték a kezelés hatékonyságát. A betegek maguk töltötték ki a CSS-skálát, és értékelték a köhögés életminőségre gyakorolt hatását. A betegek naponta értékelték a köpet jellemzőit és feljegyezték a testhőmérséklet értékeit a betegnaplóban: az 1. vizittől (1. nap) a 2. vizitig (8. nap), és jelentették a vizsgálónak az eredményeket a betegnapló részét képező papíralapú kérdőív segítségével, valamint a teljes CSS-pontszámot és a köpet (a 2–4. napon rögzített) jellemzőit. A 2. vizit alkalmával a végső hatásossági értékelést fizikális vizsgálattal is elvégezték. A klinikai laboratóriumi vizsgálatok (hematológia, klinikai biokémia és vizeletvizsgálat) eredményeit leíró statisztikával értékelték (megfigyelések száma, átlag, szórás, minimum, medián és maximum értékek).
A biztonságossági profil értékelése érdekében a klinikai vizsgálat során mindvégig nyomon követték a nemkívánatos eseményeket. A biztonságosságot kikérdezés, fizikális vizsgálat és a laboratóriumi paraméterek változásai alapján értékelték. A beteget minden egyes vizit alkalmával megkérdezték az érzeteiről és egyéb tüneteiről. A 2а (telefonos) vizitre 7 nappal (legfeljebb két napos lehetséges késéssel) a kezelés abbahagyása után került sor, hogy információt gyűjtsenek a lehetséges késői nemkívánatos eseményekről. Tekintettel a nemkívánatos eseményeket tapasztaló betegek kis számára és a nemkívánatos események alacsony számára, a csoportok közötti nem végeztek statisztikai összehasonlítást, hanem a nemkívánatos eseményeket tapasztaló betegeket teljes körűen leírták.
A vizsgálat elsődleges céljának (a TIMP nem rosszabb a RIMP-nél a bronchitis súlyossági pontszám értékének a kiindulástól a kezelés végéig bekövetkezett változásában (ΔBSS) mutatkozó különbségek tekintetében) értékelésére meghatározott non-inferioritási határérték 1,35 pont volt.
A TIMP a RIMP értékkel szembeni non-inferioritási hipotézisének értékeléséhez a csoportok közötti elsődleges hatásossági végpont összehasonlításához kovarianciaanalízis (ANCOVA) modellt használtak, amelyben a kezelés volt a faktor, a kiindulási BSS pedig a kovariáns. Az ANCOVA-modellt használták a másodlagos hatásossági végpontok értékelésére is, a kezeléssel mint faktorral és a megfelelő kiindulási pontszámmal mint kovariánssal. A kezelések közötti különbségeket a legkisebb négyzetek átlaga közötti különbséggel becsülték a megfelelő 95%-os konfidenciaintervallumokkal. A kategorikus végpontok esetében a Fisher-féle egzakt teszteket, vagy a khi-négyzet teszteket alkalmazták. A kezelési csoportok közötti összehasonlítást a folyamatos demográfiai és kiindulási végpontok tekintetében független mintákra vonatkozó kétmintás t-próbával értékelték. Ha a minta normalitása nem teljesült, a Mann–Whitney-tesztet alkalmazták.
EREDMÉNYEK
A vizsgálatban 115 beteg vett részt: 67,8% nő és 32,2% férfi. A betegek átlagéletkora 40,4 ± 12,08 év volt a TIMP-csoportban, illetve 41,6 ± 10,55 év a RIMP-csoportban. Az összehasonlított csoportok statisztikailag nem különböztek jelentősen a demográfiai jellemzők tekintetében (2. táblázat). Az eredményeket a kezelésbe bevont (ITT, intention-to-treat) populációra vonatkozóan mutatjuk be.

2. táblázat: A vizsgálatban részt vevők átlagos életkora és nem szerinti megoszlása; n = a betegek száma.
A CRP-szint mediánja mindkét csoportban 1 mg/l volt. A TIMP-csoportban hat beteg kapott korábbi terápiát, és öt beteg állt egyidejű kezelés alatt. A RIMP-csoportban hat beteg részesült előzetes terápiában, és hat beteg kapott egyidejű terápiát.
Elsődleges hatásossági végpont
A bronchitis súlyosságának ANCOVA-modell segítségével kapott korrigált átlagos változása −6,15 volt a TIMP-csoportban, és −6,25 a RIMP-csoportban. A bronchitis súlyosságának korrigált átlagos változása közötti különbség a kiindulási értékhez képest 0,11 volt, ami alacsonyabb, mint az előre meghatározott, legalább 1,35 pontos határérték (ANCOVA p = 0,6441; 95% CI: [−0,35; 0,56]), és igazolja a TIMP non-inferioritását (3. ábra). A bronchitis súlyossági pontszámának relatív átlagos változása 73,4% volt a TIMP-csoportban, illetve 73,5% a RIMP-csoportban.
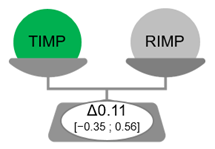
3. ábra: A vizsgált készítményekkel kapcsolatos BSS pontszám közötti átlagos különbség a tesztelt vizsgálati készítmény non-inferioritását bizonyítja. TIMP – tesztelt vizsgálati készítmény; RIMP – referencia vizsgálati készítmény; Δ – a bronchitis súlyosságának a kiindulási értékhez viszonyított korrigált átlagos változása közötti különbség
Az elsődleges hatásossági végpont a BSS pontszámának átlagos változása a kiindulási értéktől a kezelés végéig, amely a következő tüneteket foglalja magában: köhögés, köpetürítés, hallgatózás során mért légzésszám, mellkasi fájdalom köhögéskor és nehézlégzés. Az egyes tünetek értékelése után összegezték az egyes tünetek teljes pontszámát. A TIMP esetében a mellkasi fájdalom köhögés közben a vizsgált csoport 96,5%-ánál volt jelen. A terápia kezdetén (1. vizit) a betegek 52,6%-ának enyhe, 40,4%-ának közepes, 3,5%-ának pedig súlyos mellkasi fájdalma volt. A 2. vizitkor csak egy betegnek (1,8%) volt enyhe mellkasi fájdalma, a TIMP-csoport többi tagja nem tapasztalt mellkasi fájdalmat köhögés közben. Ami a RIMP csoportot illeti, a kezelés kezdetén a betegek 94,8%-a tapasztalt mellkasi fájdalmat köhögés közben. A mellkasi fájdalom súlyossága többnyire közepes (50,0%) volt, ezt követte az enyhe (43,1%) és a súlyos fájdalom (1,7%). A 2. vizitkor a betegek 19%-a tapasztalt enyhe mellkasi fájdalmat köhögés közben, és egyiküknek sem volt közepes vagy súlyos mellkasi fájdalma. A köpettermelés mindkét vizsgált csoportban csökkent a kezelés során. Az 1. vizit alkalmával a betegek köpettermelése többnyire enyhe vagy közepes mértékű volt (86,0% a TIMP-csoportban és 81,1% a RIMP-csoportban). A 2. vizitkor a TIMP-csoportban nem volt köpettermelés vagy enyhe volt, a RIMP-csoportban pedig nem volt köpettermelés, illetve enyhe vagy mérsékelt volt. A nyák viszkozitása is csökkent a kezelés során (4. ábra).
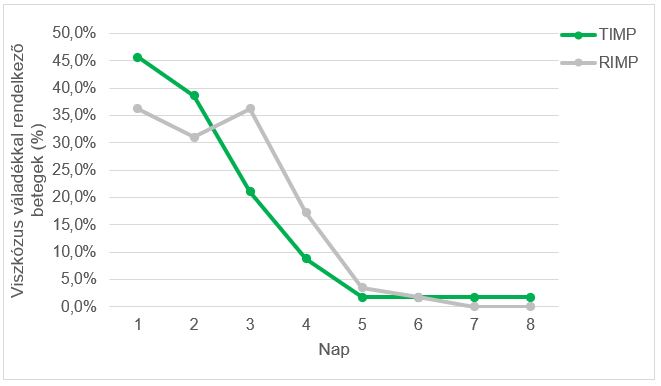
4. ábra: A váladék konzisztenciája – a viszkózus váladékkal rendelkező betegek százalékos aránya a kezelési napokon a TIMP- (n = 57) és a RIMP- (n = 58) csoportban. TIMP – tesztelt vizsgálati készítmény; RIMP – referencia vizsgálati készítmény
A TIMP-csoportban a betegek 61,4%-ának, a RIMP-csoportban pedig a betegek 58,6%-ának volt légszomja. A 2. vizit alkalmával a TIMP-csoportban a betegek 98,2%-ának, a RIMP-csoportban pedig 93,1%-uknak nem volt légszomja. A köhögést 5 pontos verbális leíró pontszámokkal értékelték egy 0-tól (nincs) 4-ig (nagyon erős) terjedő skálán. Az 1. vizit alkalmával a köhögés leggyakrabban (78,9% a TIMP- és 79,3% a RIMP-csoportban) erős volt. A 2. vizitkor a legtöbb betegnek (75,4% a TIMP-csoportban és 77,6% a RIMP-csoportban) enyhe köhögése volt. A hallgatózással észlelt zörejek a TIMP-csoportban a betegek 96,5%-ánál, a és RIMP-csoportban pedig 87,9%-uknál javultak a 2. vizit idejére.
Másodlagos hatásossági végpontok
A kiindulási és a kezelés utáni értékek összehasonlítása statisztikailag szignifikáns javulást mutatott mindkét vizsgált csoportban (TIMP és RIMP) az összes vizsgált paraméter tekintetében.
A köhögés súlyosságának változása (CSEVC, change in the severity of cough)
A köhögés súlyosságának korrigált átlagos változása −59,8 volt a TIMP-csoportban és −58,7 a RIMP-csoportban, a különbség −1,1 volt a TIMP javára (95%-os CI: [−4,5; 2,3]) (5. ábra). A köhögés súlyosságának relatív átlagos csökkenése a TIMP csoportban 81,7%, a RIMP csoportban 81,1% volt.
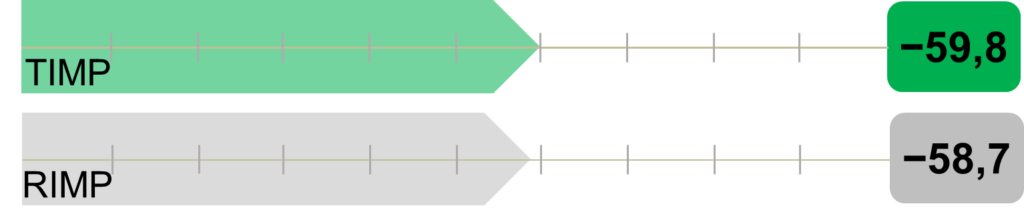
5. ábra: A köhögés súlyosságának korrigált átlagos változása a vizsgálóhelyi második vizitkor a vizsgálóhelyi első vizit során kapott kiindulási értékeléshez képest.
A köhögés súlyosságának csökkenésében nem volt szignifikáns különbség a két kezelés között (p = 0,936).
A köhögés gyakoriságának változása (CFRC, change in the frequency of cough)
A köhögés gyakoriságának a kiinduláskori és a terápia vége közötti korrigált átlagos változása −4,83 volt a TIMP-csoportban és −4,75 a RIMP-csoportban (6. ábra). A köhögési gyakoriság korrigált átlagos változása közötti különbség −0,1 volt a TIMP javára (p = 0,5377). A köhögési gyakoriság 67,5%-kal csökkent a TIMP-csoportban és 67,3%-kal a RIMP-csoportban (relatív átlagos változás).
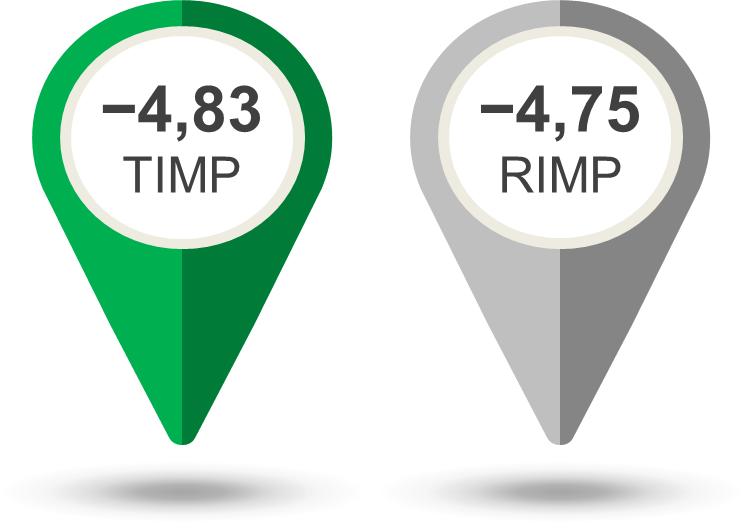
6. ábra: A köhögési gyakoriság átlagos csökkenése. TIMP – tesztelt vizsgálati készítmény; RIMP – referencia vizsgálati készítmény.
A köhögés a beteg életének különböző aspektusaira gyakorolt hatásának változása
A köhögés a beteg életének különböző aspektusaira gyakorolt hatását az LCQ segítségével értékelték, ahol az egyes területek átlagértékeinek összege képviseli a kérdőív 3-tól 21-ig terjedő teljes pontszámát. A kérdőívvel meghatározott magasabb pontszám az életminőség javulására utal. A 2. vizitkor a TIMP-csoportban 18,56, a RIMP-csoportban 18,75 volt az átlagpontszám, az átlagos változás pedig a TIMP-csoportban 7,04, a RIMP-csoportban pedig 7,28 volt. A kiindulási pontszámok és a kezelés utáni pontszámok összehasonlítását a 7. ábra mutatja.
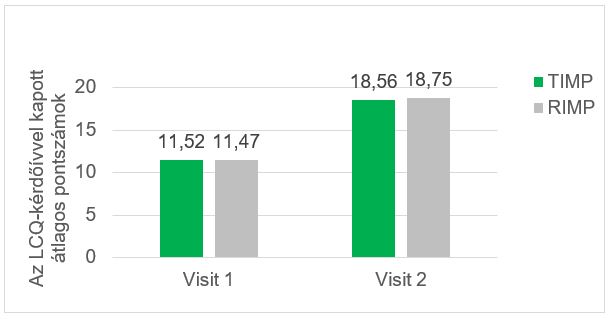
. ábra: A köhögés a beteg életének különböző aspektusaira gyakorolt hatásának átlagos pontszáma: a kiindulási időpontban (1. vizit) és a kezelés hét napja után (2. vizit) elért pontszámok összehasonlítása. TIMP – tesztelt vizsgálati készítmény; RIMP – referencia vizsgálati készítmény; LCQ – Leicester-féle köhögés kérdőív (Leicester Cough Questionnaire)
A köhögés, a beteg életének különböző aspektusaira gyakorolt hatásának korrigált átlagos változása 6,94 volt a TIMP-csoportban és 7,09 a RIMP-csoportban. A két csoport közötti átlagos változások nem szignifikáns −0,15 ponttal (p = 0,2308) különböztek.
Biztonságosság
A mellékhatások (gyógyszerrel kapcsolatos nemkívánatos események) általános előfordulása
A biztonságosságot mind a 115 betegnél értékelték. Mindkét kezelés jól tolerálható volt, ugyanis a vizsgálóorvosok egyik mellékhatást sem tekintették a vizsgált gyógyszerekkel kapcsolatosnak. 12 betegnél 14 nemkívánatos eseményt regisztráltak: a TIMP-csoportban 5 betegnél (8,8%) 6 nemkívánatos eseményt, a RIMP-csoportban 7 betegnél (12,1%) 8 nemkívánatos eseményt (3. táblázat). A betegek elsősorban neurológiai tünetekről számoltak be (fejfájás négy betegnél [7%] a TIMP-csoportban és három betegnél [5,2%] a RIMP-csoportban).
3. táblázat: A nemkívánatos események (AE) általános előfordulási aránya. TIMP – tesztelt
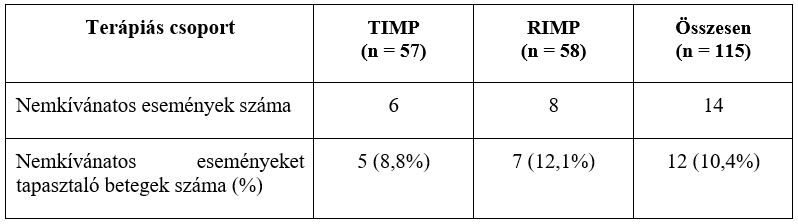
A nemkívánatos események többnyire enyhék voltak, a TIMP csoportban 4 betegnél (7,0%) 5 AE, a RIMP csoportban 6 betegnél (10,3%) 7 AE fordult elő. Két betegnél (1,7%) fordult elő mérsékelten súlyos nemkívánatos esemény: egy AE egy betegnél (1,8%) a TIMP-csoportban, és egy AE egy betegnél (1,7%) a RIMP-csoportban (8. ábra). Egyik AE sem volt súlyos és nem tette szükségessé a kezelés megszakítását.
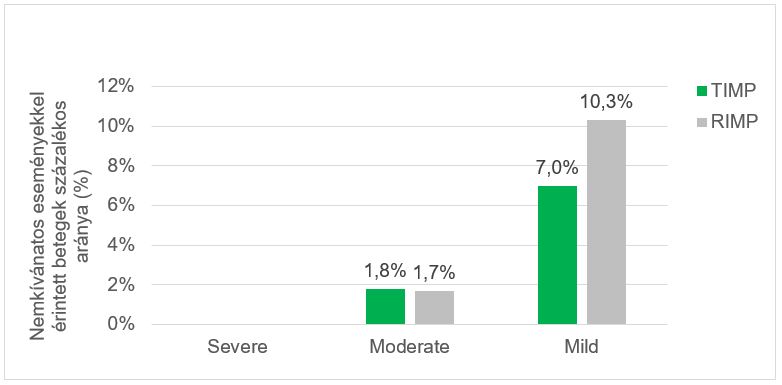
8. ábra. Nemkívánatos események súlyossági csoportok szerint (TIMP – tesztelt vizsgálati készítmény; RIMP – referencia vizsgálati készítmény)
A TIMP és a RIMP készítményt a betegek jól tolerálták, és a biztonságossági értékelés eredményei alapján ebben a vizsgálatban nem jelentettek új biztonságossági problémát ezekkel a készítményekkel kapcsolatban.
MEGBESZÉLÉS
Az akut bronchitis olyan klinikai diagnózis, amely leggyakrabban köpettermeléssel járó (produktív köhögés) akut köhögéssel és alsó légúti fertőzés jeleivel jár, és amelyet gyakran vírusok okoznak. A borostyánlevél száraz kivonatát tartalmazó készítmények köptetőszerként javallottak felnőtteknél, valamint kétéves és idősebb gyermekeknél akut légúti gyulladásokban, amelyeket köhögés, fokozott nyáktermelés és nehézlégzés kísér, illetve krónikus bronchitis akut súlyosbodása által okozott tünetek enyhítésére.
Ebben a klinikai vizsgálatban két készítményt hasonlítottak össze: a Krka borostyánlevél kivonatát tartalmazó 35 mg-os szopogató tablettáját (tesztelt készítmény) és a borostyánlevél-kivonat 35 mg granulátum belsőleges oldathoz készítményt (referenciakészítmény) akut bronchitisben jelentkező köhögésben szenvedő betegeknél. Mindkét készítmény akut bronchitishez társuló köhögésben szenvedő felnőtt betegek kezelésére szolgál. A RIMP és a TIMP azonos mennyiségű és azonos típusú borostyánlevél száraz kivonatot tartalmaz egy adagban (egy RIMP tasak megfelel a TIMP szopogató tablettának). A két vizsgált termék hatásmechanizmusa megegyezik. A referenciakészítményt az Orosz Föderációban a köpetürítési nehézséggel járó akut és krónikus gyulladásos légúti betegségek kezelésére engedélyezték, és klinikailag bizonyított hatásossággal és biztonságossággal rendelkezik. A vizsgálatba olyan betegeket vontak be, akiknél a pulmonológus megerősítette az akut bronchitis diagnózisát, és akik köhögést valamint köpetürítési nehézséget panaszoltak.
A vizsgálatban igazolták, hogy a TIMP klinikailag nem rosszabb hatású (non-inferioritás) mint a RIMP az akut bronchitishez társuló köhögésben szenvedő betegeknél a köhögés gyakorisága, a köhögés súlyossága és a köhögés életminőségre gyakorolt hatása tekintetében.
A TIMP- és a RIMP-csoport hasonló volt a demográfiai kiindulási paraméterek, az egyidejűleg alkalmazott terápia, az alapbetegségek és az általános fizikai állapot, valamint az alkalmazás kényelme szempontjából. A csoportok a kezelés betartása tekintetében is hasonló profilt mutattak.
Mindkét készítményt biztonságosnak találták az akut bronchitishez társuló köhögésben szenvedő felnőtt betegek kezeléséhez. A mellékhatások száma és a nemkívánatos események (AE) általános gyakorisága mindkét csoportban nagyon alacsony volt. Minden AE enyhe vagy mérsékelten súlyos volt, és a vizsgálat végére megszűnt. Nem volt olyan beteg, aki nemkívánatos esemény miatt nem fejezte be a vizsgálatot. A kapott adatok összhangban vannak a vizsgált készítmények hatóanyagaira vonatkozóan megállapított biztonságossági profillal, és meggyőzően igazolják azok hasonló biztonságosságát.
KÖVETKEZTETÉS
A klinikai vizsgálatban a Krka, borostyánlevél kivonatot tartalmazó 35 mg-os szopogató tablettájának klinikai hatásosságát és biztonságosságát vizsgálták a RIMP-hez képest, hogy bizonyítsák a TIMP RIMP készítményhez viszonyított non-inferioritását akut bronchitishez társuló köhögésben szenvedő betegeknél. A vizsgált csoportok között nem volt statisztikailag szignifikáns különbség a vizsgált paraméterek egyike tekintetében sem (bronchitis súlyossági pontszám, a köhögés súlyossága, a köhögés gyakorisága, a köhögés hatása a beteg életének különböző aspektusaira). A kezelés előtti és utáni értékek összehasonlítása azt mutatja, hogy mindkét fajta kezelés (a TIMP és a RIMP) statisztikailag szignifikáns javulást eredményez az összes vizsgált paraméter tekintetében. A biztonságossági elemzés egyértelműen bizonyította, hogy a Krka borostyánlevél száraz kivonatot tartalmazó 35 mg-os szopogató tablettája biztonságos és jól tolerálható az akut bronchitishez társuló köhögésben szenvedő betegeknél.
KÖSZÖNETNYILVÁNÍTÁS
A cikk szerzői köszönetet mondanak a fő vizsgálóknak, Irina Sergejevna Sedavniknak, Diana Nodarjevna Alpendizének, Anastasia Alexandrovna Bagrecovának és Veronika Borisovna Popovának. A vizsgálatok négy oroszországi kutatóközpontban zajlottak: az 51-es számú városi rendelőintézetben a 117-es számú városi rendelőintézetben, a szentpétervári Reavita Med Orvosi Központban és az arhangelszki N.A. Szemasko Északi Orvosi Klinikai Központban.
Szerzők:
- Breda Barbič-Žagar, Krka, d. d., Novo mesto, Dunajska cesta 65, 1000 Ljubljana; breda.zagar@krka.biz
- Tjaša Debelak, Krka, d. d., Novo mesto, Dunajska cesta 65, 1000 Ljubljana; tjasa.debelak@krka.biz
- Anastasiya Chezhina, KRKA-RUS, d.o.o., Moszkva, Oroszország; anastasiya.chezhina@krka.biz
- Dr. Ana Herman, Krka, d. d., Novo mesto, Dunajska cesta 56, 1000 Ljubljana; ana.herman@krka.biz
Irodalom:
- Kinkade S, Long NA. Acute Bronchitis. Am Fam Physician. 2016 Oct 1; 94 (7): 560–565.
- Schönknecht K, Fal AM, Mastalerz-Migas A, et al. Efficacy of dry extract of ivy leaves in the treatment of productive cough. Wiad Lek. 2017; 70 (6 pt 1): 1026‒1033.
- EMA: Committee on Herbal Medicinal Products (HMPC). Assessment report on Hedera helix L., folium [internet]. London: European Medicines Agency; 2017 [cited 2020 Oct 26]. Available at: https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-hedera-helix-l-folium-revision-2_en.pdf
- Lutsenko Y, Bylka W, Matławska I, et al. Hedera helix as a medicinal plant. Herba Pol. 2010; 56 (1): 83–96.
- Al-Snafi AE. Pharmacological and therapeutic activities of Hedera helix- A review. IOSR Journal Of Pharmacy. 2018; 8 (5): 41–53.
- Greunke C, Hage-Hülsmann A, Sorkalla T, et al. A systematic study on the influence of the main ingredients of an ivy leaves dry extract on the β2-adrenergic responsiveness of human airway smooth muscle cells. Pulm Pharmacol Ther. 2015; 31: 92–8.
- Schulte-Michels J, Keksel C, Häberlein H, et al. Anti-inflammatory effects of ivy leaves dry extract: influence on transcriptional activity of NFκB. Inflammopharmacology. 2019; 27 (2): 339–347.
- European Scientific Cooperative on Phytotherapy. ESCOP Monographs – the scientific foundation for herbal medicinal products. 2nd ed. Exeter: European Scientific Cooperative on Phytotherapy; 2003. p. 241–7
- Lehrl S, Matthys H, Kamin W, et al. The BSS – a valid clinical instrument to measure the severity of acute bronchitis. JLPRR. 2014; 1 (3): 00016.