A fix kombinációjú cetilpiridinum-klorid és benzidamin-hidroklorid hatóanyagtartalmú szopogató tabletta közvetlen virucid hatású a SARS-CoV-2-vel szemben
23. 8. 2021
Absztrakt:
A szájüreg és a torok területének gyulladásos megbetegedéseit leggyakrabban a vírusok okozzák. A legtöbb légúti fertőzés önkorlátozó és nem igényel konkrét kezelést. A betegek azonban gyakran alkalmaznak maguktól különböző kezeléseket, amelyekkel a betegség tüneteit és annak okát is próbálják kezelni. A fix kombinációjú benzidamin-hidroklorid és cetilpiridinum-klorid (BH/CPC) hatóanyagtartalmú szopogató tablettákról ismert, hogy hatékonyan enyhítik a torokfájást, azonban a vírusokra gyakorolt hatásukat ezidáig nem vizsgálták. Az antiszeptikus hatású cetilpiridinum-kloridról (CPC) már leírták, hogy hatékony baktericid hatású. Emellett néhány vizsgálat alapján felmerült bizonyos burkos vírusok elleni hatékonysága is. Ezért vizsgálatunk célja azt volt, hogy megvizsgáljuk a szabad hatóanyagként, illetve szopogató tabletta formájában alkalmazott CPC, valamint a BH/CPC kombináció SARS-CoV-2-re gyakorolt virucid hatását in vitro körülmények között. A szopogató tabletta alkalmazásának laboratóriumi szimulációja során a SARS-CoV-2 vírust a vizsgált hatóanyagok, azaz a CPC, a szabad BH/CPC, illetve a szopogató tabletta szuszpenzióként alkalmazott BH/CPC három különböző koncentrációjával inkubáltuk 1, 5 és 15 percen keresztül. A sejtkultúrákban kimutattuk a fertőző vírusrészecskéket, és meghatároztuk a vírustitert. Eredményeink alapján a nagy koncentrációjú szuszpenziókban lévő hatóanyagok mindegyike, illetve a közepes koncentrációjú BH/CPC kombináció a vírustiter 4-log értékű csökkenését okozta. Emellett a legnagyobb koncentrációjú, szopogató tablettaként alkalmazott BH/CPC kombináció virucid hatása gyorsabb volt, mint a szabad hatóanyagként alkalmazott CPC-é, mivel már 1 perces behatási idő után is több, mint 4 log értékű csökkenés mutatkozott a kezdeti víruskoncentrációban. Vizsgálatunk kimutatta a szopogató tabletta erős virucid hatását, amellyel lehetővé válhat a szájüregben a vírusterhelés csökkentése, és ezáltal csökkenhet a vírus átvitelének kockázata.
1. Bevezetés
A légúti fertőzések az embernél előforduló leggyakoribb fertőzések közé tartoznak, és jellegzetes tünetekkel, rhinitisszel, köhögéssel, lázzal és torokfájással járnak.
A kórokozók közül a vírusok okozzák a szájüreg és a torok területének legtöbb gyulladásos megbetegedését. A légutak bakteriális fertőzései ritkábbak és gyakran vírusfertőzést követően alakulnak ki. A légúti fertőzéseket okozó leggyakoribb vírusok közé tartoznak a pikornavírusok (humán rhinovírusok (HRV)), a koronavírusok (közönséges humán koronavírus (hCoV) OC43, 229E, NL63, HKU1), az ortho- és a paramyxovírusok (influenzavírusok, parainfluenza vírusok (PIV1-4)) és a respiratory syncytial vírus), a légúti adenovírusok és egyebek [1].
Számos cirkuláló humán kórokozó vírus lipid kettősréteg burokkal rendelkezik, és a célsejtet úgy fertőzik meg, hogy a vírusburok és a sejtmembrán összeolvadását indukálják. A burkos vírusok számos osztálya tartozik a humán patogének közé, például a légúti vírusok közül az influenzavírusok (az Orthomyxoviridae család négy nemzetsége, az influenza A, B, C és D), a respiratory syncytial vírus (RSV, Pneumoviridae család), a koronavírusok (Coronaviridae család) és továbbiak [2].
A humán koronavírusok gyakorta cirkuláló vírusok, és ezeket tekintették a második leggyakoribb közönséges vírusoknak, amelyek az emberben okozott összes felső légúti fertőzés 10–15%-áért felelősek [3]. Ezek a vírusok a nasopharynxban szaporodnak és általában enyhe, önkorlátozó felső légúti fertőzéseket okoznak rövid inkubációs idővel, bár alkalmanként alsó légúti fertőzések és pneumonia esetén is leírták már őket [4].
A virulensebb koronavírusok, például a súlyos akut légúti szindrómát okozó (severe acute respiratory syndrome) (SARS)-CoV-1 megjelenésekor 2002-ben, valamint a közel-keleti légúti szindrómát okozó (Middle East respiratory syndrome) (MERS)-CoV megjelenésekor 2012-ben felismerték, hogy a koronavírusok hosszabb inkubációs periódussal járó súlyos, és gyakran halálos kimenetelű pneumoniát is képesek okozni [5]. 2019 végén az új koronavírus, a SARS-CoV-2 által okozott koronavírus betegség 2019 (COVID-19) több mint 144 millió ember megfertőződésével és több mint három millió ember halálával járó világjárványt eredményezett [6]. A COVID-19 lehet tünetmentes, de okozhat lázzal, köhögéssel és légzési nehézséggel járó súlyos betegséget is. Emellett súlyos állapotokhoz, valamint halált is vezethet [7,8].
A légúti vírusok főként a cseppek formájában kilégzett légúti váladékkal terjednek, de fertőző közvetítő tárgyak révén történő indirekt kontaktussal is átvihetők. A fertőzés helyén a vírusterhelés csökkentése egyszerre csökkenti a két úton való terjedést, a beteg tüneteit, valamint az alsó légutakba való terjedés lehetőségét [1].
A kvaterner ammónium vegyület cetilpiridinum-klorid (CPC) egy antiszeptikum, amelynek hatása és alkalmazása megegyezik a kationos felületaktív vegyületek (surfactantok) hatásával és alkalmazásával. Emulzifikáló és detergens tulajdonságai mellett a kvaterner ammóniumvegyületek baktericid hatásúak a Gram-pozitív, illetve nagyobb koncentrációban egyes Gram-negatív baktériumok ellen is. Változó gombaellenes hatással rendelkeznek és néhány vírus ellen is hatásosak [9,10]. A virucid hatásukról széles körben nem számoltak be, bár néhány szakirodalmi beszámoló a felületi fertőtlenítéssel kapcsolatban megemlíti a burkos vírusok elleni hatásukat [11]. Ebben a vegyületcsoportban a CPC-ről nemrég mutatták ki, hogy aktív az influenza ellen in vitro és in vivo is, a vírus burkára kifejezett közvetlen hatással, in vitro 5–20 µg/ml EC50 értékkel [12]. A CPC-t általában gyógyszeres szájvíz, szopogató tabletta és sprayk formájában alkalmazzák.
A vizsgálatban a szabad hatóanyagként alkalmazott CPC, illetve benzidamin-hidroklorid (BH) és CPC kombináció, valamint a szopogató tablettaként alkalmazott BH és CPC kombináció virucid hatását vizsgáltuk in vitro.
Tudomásunk szerint ez az első vizsgálat, amelyben fix kombinációjú BH és CPC szopogató tabletta SARS-CoV-2-re gyakorolt virucid hatását értékelik.
2. Anyagok és módszerek
2.1. A sejtek előkészítése
Hét napos Vero E6 sejteket (13–16 passzázs után) tripszinnel kezeltünk, majd reszuszpendáltunk 10%-os magzati szarvasmarha szérummal (FBS) (Sigma-Aldrich, St. Louis, MO, USA) dúsított Dulbecco’s Minimal Essential Medium (DMEM) (Thermo Fisher Scientific, Waltham, MA, USA) médiumban, és így 1 × 105 sejt/ml végleges koncentrációt kaptunk. Az így elkészített 100 µl-es sejtszuszpenziót elosztottuk a 96 lyukas sejttenyésztő lemez lyukaiba, és egy éjszakán keresztül inkubáltuk 37 °C-on, 5%-os CO2 koncentráció mellett, hogy elérjük a sejtek kvantitatív szuszpenziós tesztekhez szükséges 80%-os összeolvadását.
2.2. A vírus izolációja és kvantifikációja
A SARS-CoV-2-t egy COVID-19-cel diagnosztizált beteg torokváladékából izolálták 10%-os FBS-sel dúsított DMEM médiumon tenyésztett Vero E6 sejteken. A vírust 5 alkalommal vitték át a Vero E6 sejtekre, szétosztották és további felhasználásig −80 °C-on tárolták.
A vírus koncentrációját a végpont dilúciós próbával határozták meg és medián fertőző dózis szövetkultúrán/ml (TCID50/ml) egységben fejezték ki, amit a Spearman és Kärber módszerrel számoltak ki. A törzskoncentráció minden kísérletben 1,17 × 109 TCID50/ml volt.
2.3. A reagensek előkészítése
A kísérleteink során használt minden tesztet a Krka, d. d., Novo mesto, Szlovénia bocsátott rendelkezésre, míg a reagenseket a Ljubljanai Mikrobiológiai és Immunológiai Intézet készítette. A zavaró anyag készítése során először 3 g szarvasmarha albumint oldottunk fel 97 ml vízben. Következő lépésben az elkészített és leszűrt szarvasmarha albumin oldat 97 ml-ébe 3 ml birka eritrocitát kevertünk (BioSap SEA, BioGnost, Zágráb, Horvátország) és így értük el a kísérleteinkben használt zavaró anyag végleges összetételét. A kísérlet napján aszeptikus körülmények között friss kemény vizet állítottunk elő a SIST EN 14476:2013 + A2:2019, „Kémiai fertőtlenítőszerek és antiszeptikumok. Kvantitatív szuszpenziós vizsgálat a virucid aktivitás értékelésére orvosi területen” című szabványnak megfelelően, amelyet 12 órán belül felhasználtunk [13].
Minden hatóanyagot három különböző koncentrációban készítettünk elő a vizsgált oldat hígításával 4 ml (nagy koncentráció), 20 ml (közepes koncentráció) vagy 30 ml (kis koncentráció) kemény víz felhasználásával. A hatóanyagösszetételek és a kísérleti körülmények az 1. táblázatban találhatók.
1. táblázat: A vizsgált termékek és a tesztelési körülmények.
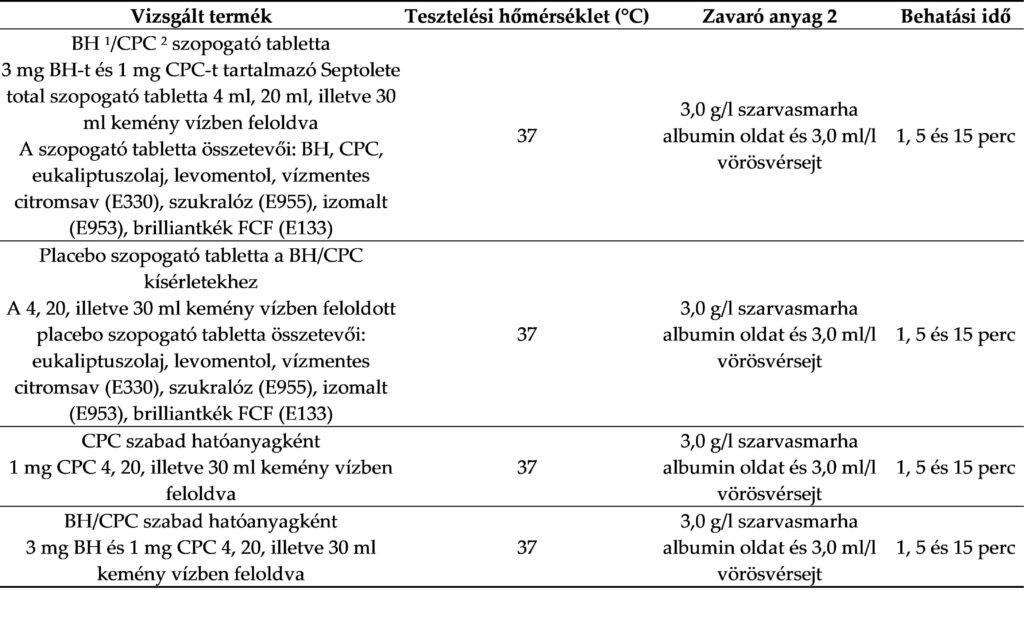
1 Benzidamin-hidroklorid; 2 cetilpiridinum-klorid.
2.4. Kvantitatív szuszpenziós teszt a virucid aktivitás értékelésére
A humán szájüreg fizikokémiai tulajdonságainak imitálásához számos tényezőt, például a hőmérsékletet, a nyál összetételét (zavaró anyag), a szopogató tabletta oldódása közben termelődő nyálmennyiséget, valamint a szopogató tabletta oldódási dinamikáját (különböző vírus-anyag behatási időkkel) figyelembe vettünk. A kísérleti eljárásokat a szabványi követelményeknek megfelelően folytattuk le. Röviden, a hatóanyagot először feloldottuk kemény vízben, majd hozzáadtunk 1:10 arányban szuszpendált SARS-CoV-2-t és zavaró anyagot. A keveréket különböző inkubációs időtartamig (1, 5 és 15 percig) 37 °C-on tároltuk. Az egyes behatási idők végén az inkubált szuszpenzió egy aliquotját egy jéghideg, 2%-os FBS-t tartalmazó sejtfenntartó DMEM médiumban hígítottuk fel, hogy azonnal elnyomjuk a használt hatóanyag virucid hatását. A kezdeti vírus elleni hatóanyag szuszpenzió 1:10–1:108 arányú hígításaiból készült hígításokat átvittük egy Vero E6 sejt monolayer 96 lyukas mikrotitrációs lemezre és 7 napon keresztül 37 °C-on és 5% CO2 koncentráció mellett inkubáltuk. Az inkubáció után a lemezeket szűrtük CPE-re, és a fertőzési titereket Spearman és Kärber módszerével számoltuk ki [14].
A felhasznált SARS-CoV-2 aliquotok esetén a vírustitrációs tesztet azonnal a felolvadás után, valamint 15 perccel később is elvégeztük, hogy értékeljük a felolvadás víruskoncentrációra gyakorolt hatását, és minden kísérlet esetén meg tudjuk határozni a pontos hatásos víruskoncentrációt.
2.5. Kontrollkísérletek
A hatóanyagok SARS-CoV-2-re gyakorolt virucid hatását értékelő kísérletek mellett a szabványnak megfelelő kontrollvizsgálatokra is sor került.
Minden kísérletnél használtunk negatív kontrollként szolgáló kezeletlen sejteket, hogy információt kapjunk a sejtek életképességéről a teljes inkubációs időszak alatt.
Minden kvantitatív szuszpenziós teszt esetén víruséletképességi tesztet is végeztünk, hogy megállapítsuk a vírus stabilitását a fenntartó médiumban, illetve hogy minden behatási idő mellett értékeljük a vírus fertőzőképességét a kísérleti körülmények között. 0,1 ml vírusszuszpenzió, 0,1 ml zavaró anyag és 0,8 ml kemény víz keverékét inkubáltuk 37 °C-on 15 percen keresztül. Az inkubáció kezdetén és 15 perccel az inkubációt követően 0,1 ml mintát vettünk. Tízszeres hígítási sort készítettünk 1%-os FBS-t tartalmazó DMEM médiumban, és a hígítási sor tagjaiból 100–100 µl-t hozzáadtunk minden egyes mintamélyedéshez nyolc példányban.
A kísérleti körülmények között a Vero E6 sejteken a hatóanyag által okozott citotoxikus hatás következtében fellépő morfológiai változások miatt kialakuló falspozitív eredmények elkerülése érdekében meghatároztuk a vizsgált anyag legnagyobb koncentrációját, amely még nem okozza a sejtek látható morfológiai elváltozását. Először a vizsgált anyag tízszeres hígításait helyeztük a fenntartó médiumba, és minden hígításból 100 µl-t nyolc példányban átvittünk a sejt monolayerre. A sejteket 48 órán keresztül inkubáltuk, majd megvizsgáltuk, hogy vannak-e rajtuk morfológiai elváltozások.
Meghatároztuk továbbá a jéghideg médium gátló hatását a vizsgált termék virucid aktivására. 0,1 ml zavaró anyag, 0,1 ml fenntartó médium és 0,8 ml vizsgált termékből készítettünk szuszpenziót. Majd az így elkészített keverékből 0,1 ml-t bejuttattunk 0,8 ml jéghideg fenntartó médiumba, és 4 °C-os hőmérsékletre helyeztük. Ezt követően 0,1 ml vírusszuszpenziót adtunk a jéghideg szuszpenzióhoz és jégen 15 percen keresztül inkubáltuk. Az inkubálás után hígítási sort készítettünk, amelyekből 8–8 példányt átvittünk a sejtkultúrákra.
Hogy meghatározzuk a hatóanyag legnagyobb nem citotoxikus koncentrációjának hatását a sejt vírusérzékenységére, a vizsgálat anyagokból tízszeres hígítási sort készítettünk a fenntartó médiumban, eltávolítottuk a tenyésztő médiumot, és hozzáadtunk 100–100 µl-t az elkészített hatóanyag-hígításból nyolc példányban a sejt monolayerekhez. Egy órás 37 °C-on és 5% CO2 koncentráció mellett végzett inkubáció után a felülúszókat eltávolítottuk, a sejteket lemostuk a fenntartó médiummal és beoltottuk őket a SARS-CoV-2 tízszeres hígítási sorával.
Minden kontrollvizsgálatot a kvantitatív szuszpenziós tesztekkel egyidőben és azonos körülmények között végeztünk el.
2.6. Elektronmikroszkópos vizsgálat
A szabad hatóanyagként vizsgált CPC és a szopogató tablettaként vizsgált BH/CPC vírusmorfológiára gyakorolt hatását elektronmikroszkóppal is megvizsgáltuk. A vírusrészecskéket transzmissziós elektronmikroszkóp alatt vizsgáltuk meg nagy koncentrációjú szuszpenzióban alkalmazott CPC és BH/CPC szopogató tabletta alkalmazása után. A vizsgált anyagból (illetve a negatív kontrollhoz a fenntartó médiumból) 800 µl szuszpenziót készítettünk, majd hozzáadtunk 100 µl zavaró anyagot és 100 µl vírusszuszpenziót. 15 perces 37 °C-os behatási idő után végeztük az elektronmikroszkópos vizsgálatot. Az elektronmikroszkópos grideket (400-as rézgrid Formvar bevonattal, karbon megerősítéssel) az Airfuge rendszeren végzett ultracentrifugálással készítettük elő. A koncentrált vírusrészecskékkel előkészített grideken 2%-os foszfotungsztinsavval végeztünk negatív festést, majd 30 000–100 000-szeres nagyításon vizsgáltuk transzmissziós elektronmikroszkóppal.
2.7. Statisztikai elemzés
A hatóanyagok SARS-CoV-2 koncentrációjára és infektivitására gyakorolt hatásának értékeléséhez összehasonlítottuk a háromféle inkubációs időszak után számított víruskoncentrációkat a különböző hatóanyagok között, egy független t-teszttel az SPSS Statistics V26 szoftver segítségével.
3. Eredmények
3.1. A kontrolleljárások eredményei
3.1.1. Sejtek és víruskontroll
Minden vizsgálathoz sejt- és víruskontroll vizsgálatot is végeztünk párhuzamosan. Minden kontroll megfelelt a kritériumoknak.
3.1.2. Víruskontroll a teszt teljes hatóidejére
A vizsgált vírusszuszpenziókat 15 percig inkubáltuk, amely a teszteljárás teljes inkubációs ideje volt. Minden egyes virucid teszttel párhuzamosan elvégeztük. A megfigyelt időszakban a fertőző víruskoncentráció nem csökkent szignifikánsan. A szabad hatóanyagként alkalmazott BH és a CPC kombináció, valamint a placebo szopogató tabletta alacsony koncentrációjának vizsgálatakor a fertőző víruskoncentráció kritikus (1 logaritmus értékű) csökkenése volt észlelhető. Az eredményeket a 2. táblázatban tüntettük fel.
2. táblázat: Az infektív vírusok stabilitási vizsgálata a vizsgálat során az inkubációs periódus alatt.

CPC – cetilpiridinum-klorid; BH – benzidamin-hidroklorid; CI – konfidenciaintervallum; TCID50 – medián fertőző dózis szövetkultúrán
3.1.3. A vizsgált termék hatásának gátlása jéghideg médiummal
A vizsgálatot a vizsgálandó termékek nagy koncentrációjával végeztük. Az eredményeket a 3. táblázatban tüntettük fel. A jéghideg médium inhibitoros hatása a vizsgált termék hatására, a vírus infektivitása ellen alkalmazott nagy koncentráció mellett bebizonyosodott. A vírustiter az expozíció előtt és után nem különbözött szignifikánsan, és nem közelítette meg a standard irányelvekben meghatározott 1 log értékű koncentrációkülönbséget.
3.1.4. Interferenciakontroll – a sejtek fogékonyságának kontrollja
A zavaró anyagokra vonatkozó kontrollt két külön eljárás keretében vizsgáltuk: először a szabad hatóanyagként alkalmazott CPC és BH/CPC szopogató tabletta mellett, majd szabad hatóanyagként alkalmazott BH/CPC és placebo szopogató tabletta mellett. A vírus koncentrációja az expozíciónak kitett sejtekben valamelyest alacsonyabb volt, mint a nem kitett sejtekben. A különbség azonban még elfogadható volt, és az 1 log értékű eltérésen belül volt. Az eredmények alapján a vizsgálat során alkalmazott termékeknek nem volt jelentős hatása a sejtek vírusfertőzéssel szembeni fogékonyságára.
3. táblázat: A vizsgált termék szuppressziós hatásának hatékonysága.
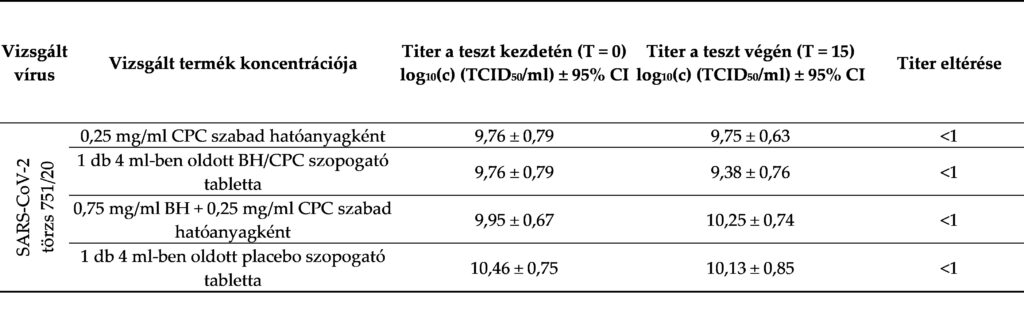
CPC – cetilpiridinum-klorid; BH – benzidamin-hidroklorid; CI – konfidenciaintervallum; TCID50 – medián fertőző dózis szövetkultúrán
3.1.5. Citotoxikus hatás
A kezdeti koncentrációt 10–1-től 10–11 hígítási sorral vizsgáltuk és a citotoxikus hatás (a sejtek deformációja és a sejt monolayer destrukciója) a 10–1 és a 10–2 hígítások mellett volt megfigyelhető. A víruspropagációs hatást csak a 10-3–10-11 hígításokkal inokulált sejteknél ellenőriztük. Ezt a megfigyelést figyelembe vettük az eredmények interpretációjánál (citotoxikus szint). A citotoxicitás szintje a vírus hígításhoz képest 4,5 log10(c) (TCID50/ml) volt a szabad hatóanyagként alkalmazott hígítatlan BH/CPC, a BH/CPC szopogató tabletta és a placebo szopogató tabletta mellett. A médiumban alacsony koncentrációban jelen lévő minden egyéb vizsgált termék és a szabad hatóanyagként, nagy koncentrációban alkalmazott CPC esetén a citotoxicitás szintje 3,5 log10(c) (TCID50/ml) volt.
3.2. A vizsgált termék vírusinaktivációra gyakorolt hatásával kapcsolatos eredmények
A vírust mind a három vizsgált koncentrációban 1, 5 és 15 perces expozíciónak tették ki. Minden tesztet elvégeztek egy másik napon is. Az SARS-CoV-2 a vizsgált termék nagy koncentrációjú szuszpenziójával, hosszú ideig végzett expozíciójának grafikus eredményei az 1. ábrán láthatók, amelyen az adott vizsgált termék virucid hatásai vannak feltüntetve.
A számszerű eredmények és csökkenések a két teszt átlagaként vannak feltüntetve a 4. és az S1. táblázatban.
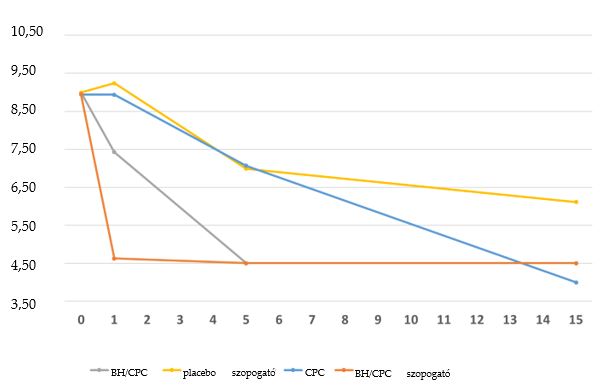
1. ábra: A SARS-CoV-2 expozíciója a nagy koncentrációjú vizsgált terméknek, és a behatási idők; CPC – cetilpiridinum-klorid; BH – benzidamin-hidroklorid; TCID50 – medián fertőző dózis szövetkultúrán.
3.2.1. A vizsgált termékek hatásai nagy koncentrációban
Szabad hatóanyag:A CPC az 1, 5 és 15 perces expozíció mellett sorrendben 0,00 ± 1,06; 1,88 ± 0,96 és 4,94 ± 0,75 átlagos log10 mértékű csökkenést okozott a vírustiterben. A BH/CPC mellett az 1, 5 és 15 perces expozíció mellett sorrendben 1,57 ± 0,86; ≥4,49 ± 0,67 és ≥4,49 ± 0,67 átlagos log10 értékű csökkenés volt megfigyelhető.
Szopogató tabletta: A BH/CPC mellett a vírustiter már 1 perces expozíció után 4,32 ± 0,82 átlagos log10 értékű csökkenést mutatott, 5 és 15 perces expozíció után pedig ≥4,44 ± 0,75-et.
A placebo szopogató tabletta a vártnak megfelelően jóval kisebb mértékű csökkenést okozott. 1 perces expozíciót követően a vírustiter 0,25 ± 1,01 mértékű növekedése volt megfigyelhető, amit 5 perces expozíció után 2,00 ± 0,92, 15 perces expozíció után pedig 2,88 ± 0,83 mértékű csökkenés követett.
A negatív kontroll semmilyen negatív hatást nem gyakorolt a vírustiterre.
4. táblázat: A vizsgált termékek koncentrációi és pH-értéke, illetve az infektív víruskoncentráció logaritmikus csökkenése az egyes behatási idők szerint
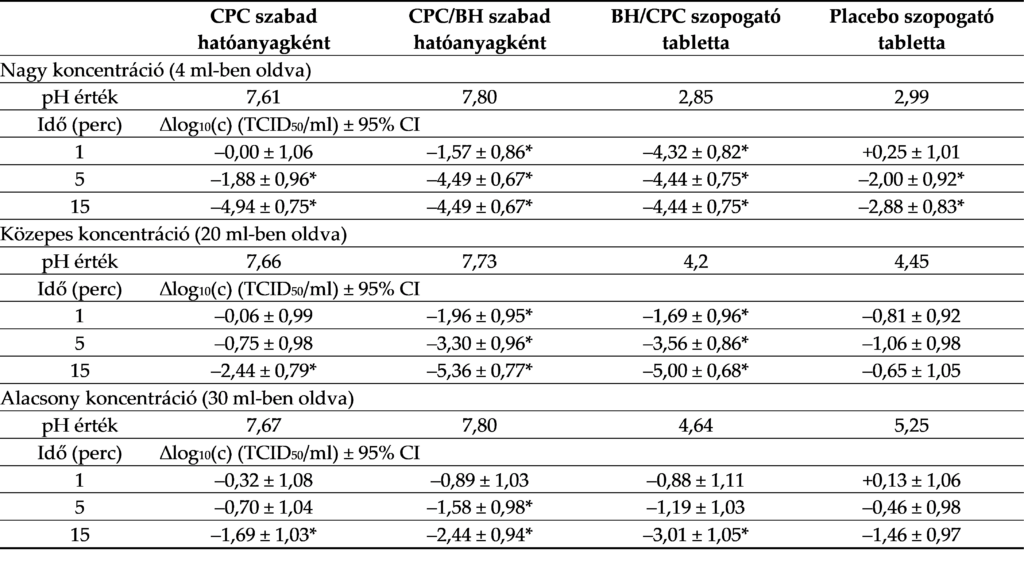
CPC – cetilpiridinum-klorid; BH – benzidamin-hidroklorid; CI – konfidenciaintervallum; * a vírustiter statisztikailag szignifikáns csökkenése (p < 0,05).
3.2.2. A vizsgált termékek hatásai közepes koncentrációban
Szabad hatóanyag:A szabad hatóanyagként alkalmazott CPC mellett az 1, 5 és 15 perces expozíció esetén sorrendben 0,06 ± 0,99; 0,75 ± 0,98 és 2,44 ± 0,79 átlagos log10 mértékű csökkenés volt megfigyelhető. BH/CPC mellett ezek az értékek 1, 5 és 15 perces expozíció esetén sorrendben 1,96 ± 0,95; 3,30 ± 0,96 és 5,63 ± 0,77 voltak.
Szopogató tabletta:A BH/CPC mellett az 1, 5 és 15 perces expozíció esetén sorrendben 1,69 ± 0,96; 3,56 ± 0,86 és 5,00 ± 0,68 átlagos log10 értékű csökkenés volt megfigyelhető. A placebo szopogató tabletta mellett ezek az értékek 1, 5 és 15 perces expozíció esetén sorrendben 0,81 ± 0,92; 1,06 ± 0,98 és 0,65 ± 1,05 voltak. A negatív kontroll semmilyen negatív hatást nem gyakorolt a vírustiterre.
3.2.3. A vizsgált termékek hatásai alacsony koncentrációban
Szabad hatóanyag: A CPC mellett az 1, 5 és 15 perces expozíció esetén sorrendben 0,32 ± 1,08; 0,70 ± 1,04 és 1,69 ± 1,03 log10 értékű csökkenés volt megfigyelhető. A BH/CPC kombináció mellett a csökkenés 0,89 ± 1,03; 1,58 ± 0,98 és 2,44 ± 0,94 volt.
Szopogató tabletta: A BH/CPC kombináció mellett az 1, 5 és 15 perces expozíció esetén sorrendben 0,88 ± 1,11; 1,19 ± 1,03 és 3,01 ± 1,05 átlagos log10 értékű csökkenés volt megfigyelhető. A placebo szopogató tabletta mellett 1 perces expozíció után a vírustiter 0,13 ± 1,06 értékben nőtt, majd 5 és 15 perces expozíció után 0,46 ± 0,98 illetve 1,46 ± 0,97 mértékben csökkent. A negatív kontroll semmilyen negatív hatást nem gyakorolt a vírustiterre.
3.3. Elektronmikroszkópos elemzés
Az elektronmikroszkóp alatt megfigyelt negatív kontroll minták intakt vírusrészecskéket tartalmaztak, amelyeken nem volt látható morfológiai elváltozás vagy károsodás; egyértelműen jelen voltak az S protein (korona) peplomerjei, és sértetlen volt a vírus burka is (2A,B ábra). Ezzel szemben a nagy koncentrációjú termékeknek (szabad hatóanyagként alkalmazott) CPC-nek (2C, D ábra) vagy BH/CPC szopogató tablettának (2E, F ábra) kitett mintákban a vírus burkának destrukciója látható felbomlott peplomerekkel vagy akár peplomerek, illetve a burok nélkül. A vizsgált termékeknek kitett vírus burkának külső rétege súlyosan károsodott, és ez a legvalószínűbb oka a vírus infektivitás megszűnésének. Néhány károsodott vírusban a belső nukleokapszid láthatóvá vált. A vírus burkának destrukciója szintén észlelhető volt, és kontrasztanyag halmozás mutatkozott a vírus belső oldalán (a vírus belseje fekete).
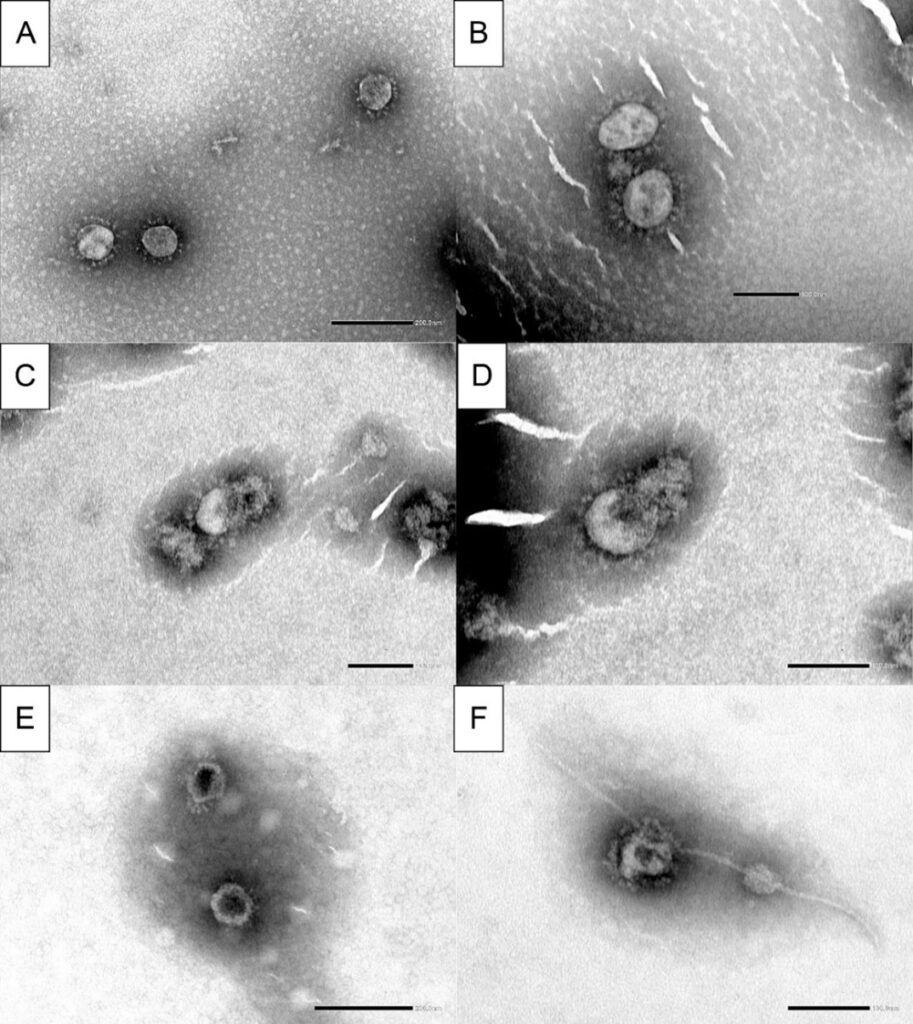
2. ábra: A vírusrészecskék elektronmikroszkópos képe ultracentrifugálás után, és negatív festés. (A,B) – a vizsgált termékkel nem érintkező vírusrészecskék a fenntartó médiumban; 50 000-szeres nagyítás (A) és 80 000-szeres (B) nagyítás; intakt SARS-CoV-2 részecskék peplomerekkel (koronával). (C,D) – 15 perces expozíció magas CPC koncentráció (0,25 mg/ml) mellett; 80 000-szeres (C) és 100 000-szeres (D) nagyítás; sérült vírusrészecskék, ritkán látható peplomerek, sérült burok és láthatóvá vált belső nukleokapszid. (E,F) – 15 perces expozíció magas BH/CPC koncentrációjú szopogató tabletta (1 db 4 ml-ben oldott szopogató tabletta) mellett; 60 000-szeres (E) és 100 000-szeres (F) nagyítás; a külső réteg károsodása és a negatív festékanyag halmozódása a nukleokapszidban (a vírus belseje fekete), ritkán látható peplomerek, a külső réteg és a nukleokapszid destrukciója (F).
4. Megbeszélés
A CPC virucid hatását vizsgáltuk és igazoltuk bizonyos burokkal rendelkező vírusok esetén [12]. Ebben az in vitro vizsgálatban alátámasztottuk a CPC, valamint a szabad hatóanyagként, illetve szopogató tablettaként alkalmazott BH és CPC SARS-CoV-2 vírusra gyakorolt virucid hatását.
A kontrollált laboratóriumi körülmények között a vizsgált termékek nagy koncentrációjú szuszpenzióival végzett virucid teszt a fertőző víruskoncentráció 10 000-szeres (99,99%-os), azaz 4 log értékű csökkenését mutatta, ami a virucid aktivitásra vonatkozó szabványban előírt mértékű csökkenés.
A fertőző vírusok csökkenésének sebessége a vizsgált termék koncentrációjával együtt csökken. Az aktív BH/CPC, illetve placebo szopogató tabletta virucid aktivitása között szignifikáns különbséget is kimutattak, különösen a vizsgált termékek közepes és magas koncentrációja mellett.
A kombinált BH/CPC szopogató tabletta gyorsabb virucid hatást mutatott, mint a szabad hatóanyagként alkalmazott CPC, mivel az elegendő, 4 log értékű víruskoncentráció-csökkenés magas koncentráció mellett már egy perces expozíció után is kialakult. Hasonló mértékű csökkenés a szabad hatóanyagként alkalmazott CPC mellett csak 15 perces expozíció után volt észlelhető, illetve a BH/CPC szopogató tabletta közepes (20 ml-ben oldott szopogató tabletta) koncentrációja esetén 5 és 15 perces expozíció mellett, amely az a koncentráció, amely elméletileg elérhető lehet egy szopogató tabletta tényleges használatakor.
Ha a teljes nyáláramlást kb. 4,0–5,0 ml/percnek vesszük az evés, a rágás és egyéb stimuláló tevékenységek (pl. szopogató tabletta szopogatása) alatt [15] és figyelembe vesszük a szopogató tabletta feloldódásához szükséges időt (átlagosan 5 perc), valamint a szopogató tablettából a hatóanyagok folyamatos felszabadulását, akkor a vizsgált termék e közepes koncentrációja (20 ml-ben oldott vizsgált termék) elméletileg elérhető a szájban szopogatott tabletta tényleges használatával.
A 30 ml-ben oldott (alacsony koncentrációjú) szopogató tabletta azonban nem érte el a 4 log értékű csökkenést 15 perc alatt. A szabad hatóanyagként alkalmazott CPC mellett szintén nem volt megfigyelhető 15 perces expozíció után a 4 log értékű csökkenés a közepes és az alacsony koncentrációjú oldatokban. Viszont minden koncentráció mellett egyértelmű víruscsökkenési trend mutatkozott (kivéve a placebo szopogató tabletta esetén) a 15 perces behatási idő alatt.
A vizsgálat fontos kiegészítő adata, hogy az akár szabad hatóanyagként, akár szopogató tablettában alkalmazott BH/CPC kombináció nagyon hatékony virucid aktivitása gyorsabban kialakult, mint az önmagában alkalmazott CPC esetén. Feltételezésünk az, hogy a BH, azaz a hozzáadott alkotórész destabilizálja a vírusrészecskéket és megszünteti a vírusrészecskék fertőzőképességét. A szopogató tabletta oldat a virucid dinamikát befolyásoló másik hatása lehet az extrém savas környezet. A szabad hatóanyagként alkalmazott CPC, illetve BH/CPC esetén a pH érték minden vizsgált koncentráció esetén átlagosan 7,65 és 7,78 között volt, ami majdnem semleges. A BH/CPC szopogató tabletta esetén a pH-érték azonban átlagosan 3,90 volt. Úgy látszik, hogy a BH/CPC szopogató tabletta oldat alacsony pH-értéke egy további tényező lehet, amely szinergisztikus hatással bír a vírus infektivitásának nagyon gyors megszüntetésében. Vizsgálatok azt is alátámasztották, hogy a pH-értéknek fontos szerepe van a vírus stabilitásának és a környezetben való fertőzőképességének megőrzésében, illetve elvesztésében [16]. A felszínen lévő vírusproteinek extrém savas és extrém lúgos környezetben is irreverzibilisen denaturálódtak, ami a fertőzőképesség megszűnését okozta.
A CPC és a BH/CPC szopogató tabletta virucid hatása a vírusrészecskék morfológiai elemzése során is látható volt. A szabad hatóanyagként használt CPC, illetve a BH/CPC szopogató tabletta szuszpenziókban végzett vírusinkubáció után azonos hatásokat, a vírus burkának destrukcióját észleltük. A BH/CPC szopogató tabletta esetén a nukleokapszid destabilizációja volt megfigyelhető, ami lehetséges, hogy az alacsony pH értéknek volt köszönhető, amellyel a vírusok érintkeztek [17].
Hangsúlyozni kell, hogy a torok szopogató tabletta hatásának helye a száj és a garatív nyálkahártyája, amelyet in vitro laboratóriumi körülmények között nehéz szimulálni. Egy további szempont, amit figyelembe kell venni az, hogy a torok szopogató tabletta in vivo potenciális hatását csak a fertőzött sejtekből kiszabaduló, illetve a nyálban lévő vírusokra tudja kifejteni. Korábbi vizsgálatokban kimutatták, hogy a nyálba felszabaduló vírusok koncentrációja 4–6 log10 genomkópia per milliliter [18–20], ami a tünetek megjelenését követő ötödik-hatodik napon kialakuló legmagasabb koncentráció. Ebben a vizsgálatban a vírus koncentrációja sokkal nagyobb volt, 8,00 és 10,00 log10 TCID50/ml.
A SARS-CoV-2 fertőzés módjának jelenleg a légúti cseppfertőzést tekintik, és a vírusrészecske az aeroszolban akár három óráig életképes [21,22]. A megelőző intézkedések, például a kézhigiéné, az arcmaszk használata és a szociális távolságtartás a közösségi infekciókontroll elsődleges eszközei. A tüdő és a torok vírusterhelése, azaz a betegség súlyossága közötti kapcsolat a mai napig ismeretlen, ahogyan azt sem tudjuk, hogy a torok vírusterhelésének csökkentése hogyan érintené a kialakuló tüdőbetegséget, illetve a vírus átvitelét. Ha a torokban lévő nagyobb víruskoncentráció fokozhatja mások megfertőzésének kockázatát, akkor a nyálkahártyákon lévő infektív vírusok számának csökkentését célzó stratégiákkal csökkenthető lenne a transzmisszió kockázata. Ezért, ha azt feltételezzük, hogy a korai replikáció legfőbb helye a torok, akkor a vírus lipidburkának károsításán vagy elroncsolásán keresztül ható helyi készítmények használatával csökkenthető lenne az oropharynx vírusterhelése.
Több esetjelentés is alátámasztotta, hogy a szájöblítők használata csökkenti a nyál SARS-CoV-2 tartalmát [23–25].
A BH/CPC szopogató tabletta virucid aktivitásának mechanizmusa és klinikai hatása további kutatást igényel a légúti fertőzések korlátozása érdekében.
5. Következtetések
A vizsgálatban bemutatott eredményeket kontrollált és a szájüreg élettani állapotának szimulálására meghatározott laboratóriumi körülmények között kaptuk. Minden aktív vizsgált készítmény, azaz a szabad hatóanyagként alkalmazott CPC, BH/CPCP, illetve a szopogató tablettaként alkalmazott BH/CPC jelentős virucid aktivitást fejt ki in vitro körülmények között.
A vizsgálatban emellett szignifikáns különbséget is észleltünk a BH/CPC és a placebo szopogató tabletta hatása között, valamint a BH/CPC kombináció nagyobb hatását akár szopogató tablettaként, akár szabad hatóanyagként alkalmazva az önmagában alkalmazott CPC-vel szemben.
Orvostudományi kar, Mikrobiológiai és Immunológiai Intézet, Ljubljanai Egyetem, Zaloška 4,
SI-1000 Ljubljana, Szlovénia; misa.marusic@mf.uni-lj.si (M.M.); marko.kolenc@mf.uni-lj.si (M.K.); tina.triglav@mf.uni-lj.si (T.T.)
*Kapcsolattartó: andrej.steyer@mf.uni-lj.si; Tel.: +386-1-543-7459
- Kiegészítő anyagok: Az alábbiak online a következő címen érhetők el: www.mdpi.com/xxx/s1, S1. táblázat: A SARS-CoV-2 elleni virucid aktivitás vizsgálatának számszerű eredményei, S2. táblázat: A vizsgált termékek koncentrációi és pH-értéke, illetve az infektív víruskoncentráció logaritmikus csökkenése az egyes behatási idők szerint.
- A szerzők feladatai: Koncepció: A.S. és T.T.; módszertan: A.S., M.M. és M.K.; adatkezelés: A.S.; írás – az eredeti kézirat elkészítése: A.S. és M.M.; írás – a kézirat ellenőrzése és szerkesztése: T.T.; ábrák és grafikonok: M.K. Minden szerző elolvasta a kézirat publikált verzióját és egyetértett a benne foglaltakkal.
- Támogatás: A vizsgálatot a Krka, d.d., Novo mesto és részben a Szlovén Kutatóintézet (szerződésszám: P3-0083) támogatta.
- Köszönetnyilvánítás: A szerzők köszönetet mondanak Katarina Resman Rusnak a sejtvonalak fenntartásáért.
- Érdekütközések: A szerzők nem tudnak érdekütközésről. A vizsgálat támogatói nem vettek részt a vizsgálat felépítésének kialakításában, illetve az adatgyűjtésben, az adatelemzésben, valamint azok értelmezésében, sem a kézirat megírásában.
Irodalom:
- Morokutti-Kurz, M.; Graf, C.; Prieschl-Grassauer, E. Amylmetacresol/2,4-dichlorobenzyl alcohol, hexylresorcinol, or carrageenan lozenges as active treatments for sore throat. Int. J. Gen. Med. 2017, 10, 53–60.
- Rey, F.A.; Lok, S.-M. Common Features of Enveloped Viruses and Implications for Immunogen Design for Next-Generation Vaccines. Cell 2018, 172, 1319–1334.
- Eccles, R. Understanding the symptoms of the common cold and influenza. Lancet Infect. Dis. 2005, 5, 718–725.
- Su, S.; Wong, G.; Shi, W.; Liu, J.; Lai, A.C.K.; Zhou, J.; Liu, W.; Bi, Y.; Gao, G.F. Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses. Trends Microbiol. 2016, 24, 490–502.
- de Wit, E.; van Doremalen, N.; Falzarano, D.; Munster, V.J. 2016 SARS and MERS: Recent insights into emerging coronaviruses. Nat. Rev. Microbiol. 2016, 14, 523–534.
- Worldometer. Coronavirus Cases. 2021. Available online: https://www.worldometers.info/coronavirus/?zarsrc=130 (accessed on 22 April 2021).
- Wan, S.; Xiang, Y.; Fang, W.; Zheng, Y.; Li, B.; Hu, Y.; Lang, C.; Huang, D.; Sun, Q.; Xiong, Y.; et al. Clinical features and treatment of COVID‐19 patients in northeast Chongqing. J. Med. Virol. 2020, 92, 797–806, https://doi.org/10.1002/jmv.25783.
- Hassan, S.A.; Sheikh, F.N.; Jamal, S.; Ezeh, J.K.; Akhtar, A. Coronavirus (COVID-19): A Review of Clinical Features, Diagnosis, and Treatment. Cureus 2020, 12, e7355, https://doi.org/10.7759/cureus.7355.
- Hammacher, H. Selbstmedikation, Mund-und Rachentherapeutika; Deutscher Apotheker Verlag: Stuttgart, Germany, 1990; pp. 623–630.
- Kramer, A. Hagers Handbuch der Pharmazeutischen Praxis; Springer: Berlin/Heidelberg, Germany, 1990.
- Shirai, J.; Kanno, T.; Tsuchiya, Y.; Mitsubayashi, S.; Seki, R. Effects of Chlorine, Iodine, and Quaternary Ammonium Compound Disinfectants on Several Exotic Disease Viruses. J. Vet. Med. Sci. 2000, 62, 85–92.
- Popkin, D.L.; Zilka, S.; Dimaano, M.; Fujioka, H.; Rackley, C.; Salata, R.; Griffith, A.; Mukherjee, P.K.; Ghannoum, M.A.; Esper, F. Cetylpyridinium Chloride (CPC) Exhibits Potent, Rapid Activity Against Influenza Viruses in vitro and in vivo. Pathog. Immun. 2017, 2, 253–269.
- European Committee for Standardization. 2019. SIST EN 14476:2013+A2:2019 Chemical Disinfectants and Antiseptics—Quantitative Suspension Test for the Evaluation of Virucidal Activity in the Medical Area—Test Method and Requirements (Phase 2/Step 1). Available online: https://cdn.standards.iteh.ai/samples/69634/1b7c3643f04b45f1be4cdde6f2350c27/SIST-EN-14476-2013-A2-2019.pdf (accessed on 10 of September 2020)
- Kärber, G. Beitrag zur kollektiven Behandlung pharmakologischer Reihenversuche. Naunyn-Schmiedeberg’s Arch. Pharmacol. 1931, 162, 480–483, doi:10.1007/BF01863914.
- Iorgulescu, G. Saliva between normal and pathological. Important factors in determining systemic and oral health. J. Med. Life 2010, 2, 303–307.
- Darnell, M.E.R.; Subbarao, K.; Feinstone, S.M.; Taylor, D.R. Inactivation of the coronavirus that induces severe acute respir-atory syndrome, SARS-CoV. J. Virol. Methods. 2004, 121, 85–91.
- Scheller, C.; Krebs, F.; Minkner, R.; Astner, I.; Gil-Moles, M.; Wätzig, H. Physicochemical properties of SARS-CoV-2 for drug targeting, virus inactivation and attenuation, vaccine formulation and quality control. Electrophoresis 2020, 41, 1137–1151.
- Li, Y.; Ren, B.; Peng, X.; Hu, T.; Li, J.; Gong, T.; Tang, B.; Xu, X.; Zhou, X. Saliva is a non-negligible factor in the spread of COVID-19. Mol. Oral Microbiol. 2020, 35, 141–145.
- Pan, Y.; Zhang, D.; Yang, P.; Poon, L.L.M.; Wang, Q. Viral load of SARS-CoV-2 in clinical samples. Lancet Infect. Dis. 2020, 20, 411–412, doi:10.1016/S1473-3099(20)30113-4.
- To, K.K.W.; Tsang, O.T.Y.; Leung, W.S.; Tam, A.R.; Wu, T.C.; Lung, D.C.; Yip, C.C.Y.; Cai, J.P.; Chan, J.M.C.; Chik, T.S.H.; et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: An observational cohort study. Lancet Infect. Dis. 2020, 20, 565–574.
- Zou, L.; Ruan, F.; Huang, M.; Liang, L.; Huang, H.; Hong, Z.; Yu, J.; Kang, M.; Song, Y.; Xia, J.; et al. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N. Engl. J. Med. 2020, 382, 1177–1179.
- Varia, M.; Wilson, S.; Sarwal, S.; McGeer, A.; Gournis, E.; Galanis, E. Investigation of a nosocomial outbreak of severe acute respiratory syndrome (SARS) in Toronto, Canada. CMAJ 2003, 169, 285–292.
- Yoon, J.G.; Yoon, J.; Song, J.Y.; Yoon, S.-Y.; Lim, C.S.; Seong, H.; Noh, J.Y.; Cheong, H.J.; Kim, W.J. Clinical Significance of a High SARS-CoV-2 Viral Load in the Saliva. J. Korean Med. Sci. 2020, 35, e195, doi:10.3346/jkms.2020.35.e195.
- Lamas, L.M.; Dios, P.D.; Pérez-Rodríguez, M.T.; Pérez, V.D.C.; Alvargonzalez, J.J.C.; Domínguez, A.M.L.; Feijoo, J.F.; Diniz-Freitas, M.; Posse, J.L. Is povidone iodine mouthwash effective against SARS‐CoV‐2? First in vivo tests. Oral Dis. 2020, doi:10.1111/odi.13526.
- Seneviratne, C.J.; Balan, P.; Ko, K.K.K.; Udawatte, N.S.; Lai, D.; Ng, D.H.L.; Venkatachalam, I.; Lim, K.S.; Ling, M.L.; Oon, L.; et al. Efficacy of commercial mouth-rinses on SARS-CoV-2 viral load in saliva: Randomized control trial in Singapore. Infection 2021, 49, 305–311, doi:10.1007/s15010-020-01563-9.