A maropitant használatának egyes lehetőségei az állatgyógyászatban
Készítette: Dr. Veres Adrienn Mercédesz, Dr. Jerzsele Ákos
A maropitant-citrát egy neurokinin-1 (NK-1) receptor antagonista szer, amelyet elsősorban antiemetikumként alkalmaznak széles körben a különböző háttérokból fakadó (mérgezés, utazási betegség, metabolikus ok, gyomor-bélrendszeri irritáció, kemoterápiás szerek által kiváltott stb.), jellemzően akut hányással, hányingerrel járó állapotok kezelésére kutyákban és macskákban (Hickman et al., 2008; Riviere és Papich, 2018; Sharun et al., 2021). A hányinger csillapításán keresztül közvetve étvágyfokozó hatásáért is használható, elsősorban krónikus veseelégtelenségben szenvedő macskánál vagy kemoterápiás szerek okozta étvágytalanság és hányinger esetén. A maropitant transzdermális formulációban alkalmazva is csökkenteni képes a hányás gyakoriságát, és javítja az étvágyat macskákban (Boukaache et al., 2022).
A maropitant hatását jellemzően az idegrendszer szintjén fejti ki, ahol gátolja a neuropeptid P (P-anyag, pain, fájdalom) vagy más néven neurokinin-1 hatását. A P anyag kulcsszerepet játszik a hányás kiváltásában a kemoreceptor triggerzónán (KTZ) és a hányásközponton keresztül, továbbá számos más élettani és kóros folyamatot is mediál. Számos más mediátorral együtt a fájdalomérzetet, bizonyos gyulladásos folyamatokat, illetve a vérnyomást és a hörgők tágasságát is szabályozza. A következő ábra az NK1-receptorok előfordulását mutatja be a szervezetben:
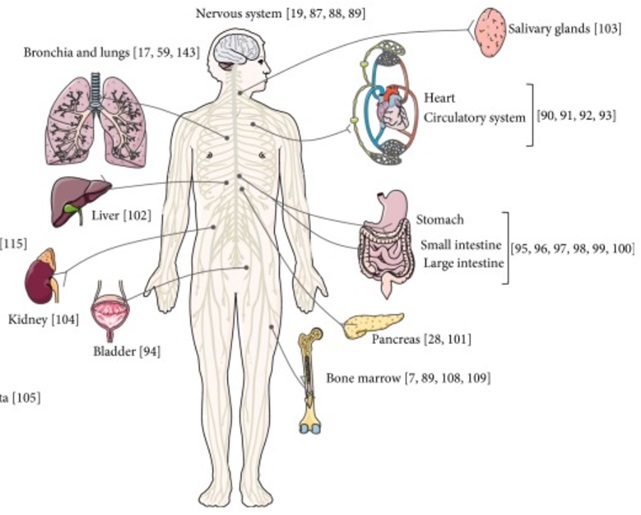
A maropitant ennek okán bármilyen eredetű és neurotranszmitteren (dopamin, szerotonin, acetilkolin, hisztamin, P anyag) keresztül megvalósuló hányinger és hányás csillapításában széles spektrumú szerként használható (Riviere és Papich, 2018). A P anyag a fájdalomérzet kialakításában is részt vesz, így a maropitant kombinációs partnerként szinergista hatással bír más analgetikumokkal (Karna et al., 2022).
Kutyákban alkalmazható a premedikáció részeként (Karna et al., 2022), így a műtéti altatás során használt anesztetikumok, különösen az inhalációs altatószerek (bizonyítottan a szevoflurán) hatásának potencírozására, ezáltal utóbbiak kisebb egyéni dózissal (16-24%-kal), MAC (minimális alveoláris koncentráció) értékkel érik el a sebészi alvásmélység eléréséhez szükséges hatékony szerkoncentrációt (Boscan et al., 2011; Hay Kraus, 2017). Jelentősen csökkenti a műtéti premedikáció során használt opioid fájdalomcsillapítók hánytató hatását (Hay Kraus, 2017; Sharun et al., 2021), továbbá hozzájárul a viszcerális fájdalomcsillapítás biztosításához, bizonyítottan az ovariohiszterektómia során a petefészkek, a méh és a szalagjaik manipulálásából fakadó fájdalom csökkentéséhez (Bozkurt et al., 2024).
Bizonyos tanulmányok szerint a maropitant támogathatja a bélmotilitás helyreállítását műtétek után enyhe prokinetikus hatásának köszönhetően, különösen hasi beavatkozásokat követően (Tsukamoto et al., 2018), illetve csökkentheti a posztoperatív gyulladásos válaszreakciókat, és így mérsékelheti az ileusz kockázatát. Ezek a feltevések azonban nem nyertek teljes bizonyítást (Kinobe és Miyake, 2020; Sharun et al., 2021).
Az NK-1 receptorok megtalálhatóak a légutak nyálkahártyájában is, ahol a P anyag bronchusgörcsöt, köhögést és gyulladást válthat ki. Ennek ismeretében a maropitant feltehetően enyhe gyulladáscsökkentő hatásánál fogva szerepet kaphat bizonyos krónikus légzőszervi betegségek (pl. krónikus bronchitis, asztma) tüneti, támogató kezelésében.Bár a maropitant köhögéscsillapító hatást is mutat, nem ajánlott önálló kezelésként alkalmazni krónikus bronchitisben, mivel nem csökkenti hatékonyan az alapbetegséghez kapcsolódó gyulladást. A köhögés elnyomása anélkül, hogy a gyulladást kezelnék, hosszú távon ronthatja a tüdőfunkciót (Grobman és Reinero, 2016). Beszámoltak a maropitant intranazális használatáról felső légúti tünetegyüttes menedzsmentjére egymásnak ellentmondó és terápiás hatást nem bizonyító eredményekkel (Parncutt et al., 2025).
A maropitant továbbá alkalmas lehet szorongásos és stresszválaszok szabályozásának elősegítésére önállóan vagy egyéb viselkedésmódosító szerekkel kombinációban, bár az állatgyógyászatban ez nem nyert még bizonyítást (Rupniak és Kramer, 2017).
A hatóanyag Magyarországon 10 mg/ml-es koncentrációban injekciós készítményként használható. Az eredetileg bőr alá adható készítmény szintén engedélyezett intravénás beadási módra is a műtéti anesztéziával és egyéb orvosi beavatkozásokkal együtt járó hányinger és hányás csillapítására. A szubkután beadási úton a szer dózisa 1 mg/ttkg, amely 45-60 perccel a beadást követően fejti ki hatását. Intravénás úton lassú (1 perc alatt) beadás javasolt a szer esetleges vérnyomáscsökkentő hatásának kivédésére. Hasznosulása az injekciós készítményből kiváló, májon keresztül történő intenzív metabolizmust követően ürül a szervezetből a vese elimináló kapacitását minimálisan igénybe véve, így dóziscsökkentésre vesebeteg állatban nincsen szükség. Tizennégy napon keresztül történő adása során sem szükséges számolni a szervezetben való felhalmozódásától (Riviere és Papich, 2018). A hatóanyag külföldön tabletta és transzdermális gél gyógyszerformában is elérhető. Szájon át való beadás esetén a szert egy órával az út előtt adva utazási betegség megelőzésére elsődleges választás lehet, bár a gyenge szájon át való biológiai hasznosulása miatt jellemzően kettő-négyszer magasabb (2-8 mg/ttkg) dózisban éri így el a kívánt hatást az injekciós beadáshoz képest. A szer szájon át való biológiai hasznosulása ugyan macskában is gyenge, viszont a kutyában elérthez képest hozzávetőlegesen kétszer kedvezőbb, így per os adagolásra a dózistartomány alsó régiója javasolt (Hickman et al., 2008; Riviere és Papich, 2018; Sharun et al., 2021). Macskák fülkagylójának belső felületén 4 mg/állat dózisban transzdermális úton hatékony és kényelmesen és stresszmentesen alkalmazható hányáscsillapító és étvágynövelő szer (Boukaache et al., 2022).
A maropitant legjelentősebb és leggyakoribb mellékhatása a szubkután alkalmazás következtében kialakuló fájdalom a beadás helyén. Ez a lokális irritáció a szabad maropitant-citrát tartalomból fakad, amely bizonyos készítmények hűtésével kivédhető, hiszen hűtő hőmérsékleten a maropitant-citrát a készítményben található ciklodextrinbe zártan komplexet képez, ezzel hozzájárulva a jobb oldhatósághoz és szöveti toleranciához (Riviere és Papich, 2018). A benzil-alkohol tartalmú készítményében az említett segédanyag jelenléte hozzájárul az injekciózással járó fájdalmasság csökkentéséhez, így ebből a célból hűtést nem igényel (Sharun et al., 2021).
Felhasznált irodalom:
Boscan, P., Monnet, E., Mama, K., Twedt, D.C., Congdon, J., Steffey, E.P., 2011. Effect of maropitant, a neurokinin 1 receptor antagonist, on anesthetic requirements during noxious visceral stimulation of the ovary in dogs. American Journal of Veterinary Research 72, 1576–1579. https://doi.org/10.2460/ajvr.72.12.1576
Boukaache, Y., Ferret, M.-L., Khoukh, V.D.-P.K., Enache, A., Iwaszkiw, D., Bertin, S., Bruno, F., 2022. Evaluation of the efficacy of transdermal administration of maropitant in managing vomiting in cats. Open Vet J 12, 618–621. https://doi.org/10.5455/OVJ.2022.v12.i5.4
Bozkurt, G., Kaya, F., Yildiz, M., 2024. Does maropitant provide more effective perioperative pain management than meloxicam in bitches undergoing ovariohysterectomy? The first report on the comparison of visceral algesia-analgesia for ovariohysterectomy. Research in Veterinary Science 169, 105179. https://doi.org/10.1016/j.rvsc.2024.105179
Garcia-Recio, S., Gascón, P., 2015. Biological and Pharmacological Aspects of the NK1-Receptor. Biomed Res Int 2015, 495704. https://doi.org/10.1155/2015/495704
Grobman, M., Reinero, C., 2016. Investigation of Neurokinin-1 Receptor Antagonism as a Novel Treatment for Chronic Bronchitis in Dogs. J Vet Intern Med 30, 847–852. https://doi.org/10.1111/jvim.13935
Hay Kraus, B.L., 2017. Spotlight on the perioperative use of maropitant citrate. Vet Med (Auckl) 8, 41–51. https://doi.org/10.2147/VMRR.S126469
Hickman, M.A., Cox, S.R., Mahabir, S., Miskell, C., Lin, J., Bunger, A., McCALL, R.B., 2008. Safety, pharmacokinetics and use of the novel NK-1 receptor antagonist maropitant (CereniaTM) for the prevention of emesis and motion sickness in cats. Journal of Veterinary Pharmacology and Therapeutics 31, 220–229. https://doi.org/10.1111/j.1365-2885.2008.00952.x
Karna, S., Chambers ,P, Singh ,P, Lopez-Villalobos ,N, and Kongara, K., 2022. Evaluation of analgesic interaction between morphine, maropitant and dexmedetomidine in dogs undergoing ovariohysterectomy. New Zealand Veterinary Journal 70, 10–21. https://doi.org/10.1080/00480169.2021.1927231
Kinobe, R.T., Miyake, Y., 2020. Evaluating the anti-inflammatory and analgesic properties of maropitant: A systematic review and meta-analysis. The Veterinary Journal 259–260, 105471. https://doi.org/10.1016/j.tvjl.2020.105471
Parncutt, J., Johnson, L.R., Subharat, S., Oke, B., Hill, K.E., 2025. Effects of intranasal maropitant on clinical signs of naturally acquired upper respiratory disease in shelter cats. Journal of Feline Medicine and Surgery 27, 1098612X241309826. https://doi.org/10.1177/1098612X241309826
Riviere, J.E., Papich, M.G., 2018. Veterinary Pharmacology and Therapeutics, 10th Edition | Wiley [WWW Document]. Wiley.com. URL https://www.wiley.com/en-us/Veterinary+Pharmacology+and+Therapeutics%2C+10th+Edition-p-9781118855829 (accessed 5.29.25).
Rupniak, N.M.J., Kramer, M.S., 2017. NK1 receptor antagonists for depression: Why a validated concept was abandoned. J Affect Disord 223, 121–125. https://doi.org/10.1016/j.jad.2017.07.042
Sharun, K., Jambagi, K., Arya, M., Aakanksha, Chaithra, S.N., Patel, P.K., Dixit, S.K., Dhama, K., 2021. Clinical Applications of Substance P (Neurokinin-1 Receptor) Antagonist in Canine Medicine. Arch Razi Inst 76, 1175–1182. https://doi.org/10.22092/ari.2021.356171.1797
TSUKAMOTO, A., OHGODA, M., HARUKI, N., Hori, M., INOMATA, T., 2018. The anti-inflammatory action of maropitant in a mouse model of acute pancreatitis. Journal of Veterinary Medical Science 80. https://doi.org/10.1292/jvms.17-0483